Amélioration de la production des plantes haploïdes et haploïdes doublés utilisant la culture des anthères du blé
Résumé
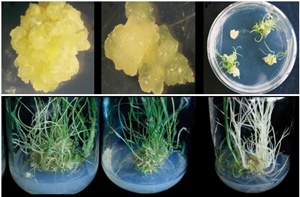
La production des plantes haploïdes et haploïdes doublés, fournit aux sélectionneurs du blé un moyen très efficace pour accélérer la production des lignées homozygotes. La culture des anthères est un parmi les processus d’induction et de régénération des haploïdes et des haploïdes doublés à partir des gamètes mâles. Son haut potentiel de production des plantes haploïdes et son applicabilité chez nombreuses espèces rendent cette technique remarquablement utilisable dans l’amélioration des plantes et l’exploitation commerciales des haploïdes doublés. De ce fait, l’objectif de cette revue est de discuter les publications les plus récentes sur l’amélioration de la culture des anthères de blé et les comparer aux résultats plus ou moins anciens. Ces publications seront d’une grande utilité dans l’amélioration du rendement des plantes haploïdes et haploïdes doublés et ils vont contribuer à faciliter les prochains travaux sur la culture des anthères.
Mots clés: Blé, culture des anthères, haploïdes, haploïdes doublés, amélioration génétique.
Téléchargements
Publié-e
Comment citer
Numéro
Rubrique
Licence

Revue Marocaine des Sciences Agronomiques et Vétérinaires est mis à disposition selon les termes de la licence Creative Commons Attribution - Pas d’Utilisation Commerciale - Partage dans les Mêmes Conditions 4.0 International.
Fondé(e) sur une œuvre à www.agrimaroc.org.
Les autorisations au-delà du champ de cette licence peuvent être obtenues à www.agrimaroc.org.

