Recherche du réservoir animal sauvage de Trypanosoma sp chez les mammifères de N'Djili-Brasseries à Kinshasa en République Démocratique du Congo (RDC)
Résumé
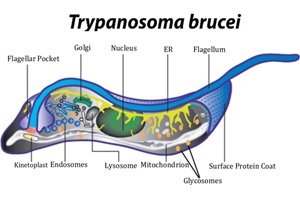
Durant 6 mois, 201 spécimens de mammifères sauvages représentant 7 espèces réparties en 6 genres, 4 familles et 3 ordres, dont 2 Genetta angolensis, 3 Nandinia binotata, 10 Galagoides demidoff, 35 Protoxerus strangeri, 73 Funisciurus congicus, 15 Rattus rattus et 63 Rattus norvegicus, ont été capturés dans le quartier N’Djili-Brasseries en vue d’identifier le réservoir animal sauvage des trypanosomes. La présente étude a montré par la méthode de la réaction de polymérisation en chaîne, ou Polymerase Chain Reaction (PCR), que de ces sept espèces, seule Rattus rattus et Rattus norvegicus capturées dans le secteur habité par l’homme avaient Trypanosoma brucei gambiense avec une prévalence de 13,3 % pour Rattus rattus et 9,5 % pour Rattus norvegicus, ce qui nous conduit à conclure que ces deux espèces seraient réservoirs de Trypanosoma brucei gambiense.
Mots clés: Réservoir, Trypanosoma sp, mammifères, N’Djili-Brasseries, Kinshasa.
Téléchargements
Publié-e
Comment citer
Numéro
Rubrique
Licence

Revue Marocaine des Sciences Agronomiques et Vétérinaires est mis à disposition selon les termes de la licence Creative Commons Attribution - Pas d’Utilisation Commerciale - Partage dans les Mêmes Conditions 4.0 International.
Fondé(e) sur une œuvre à www.agrimaroc.org.
Les autorisations au-delà du champ de cette licence peuvent être obtenues à www.agrimaroc.org.

