Epidémiologie de la trypanosomose animale africaine (TAA) à l'Ouest de la République Démocratique du Congo (RDC)
Résumé
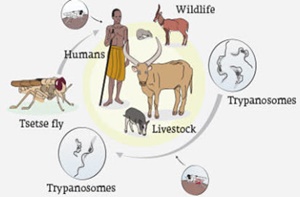
Une revue de littérature sur l’épidémiologie de la TAA à l’Ouest de la RDC a été réalisée. Concernant les trypanosomes, les études menées ont prouvé l’inexistence des trypanosomes chez les bovins N’dama à Kolo au Kongo Central, par contre à Mushie dans le Mayi Ndombe, les trypanosomes ont été mis en évidence chez les bovins N’dama, avec prédominance de T. vivax, suivie de T. congolense et de T. brucei brucei; chez les porcins de Kinshasa, T. simiae, T. vivax, T. congolense, et dans une moindre mesure, T. brucei brucei et T. brucei gambiense ont été identifiés; au Kongo Central, T. congolense, T. vivax et T. brucei brucei ont été isolés chez les caprins à Kimpika, Kasangulu, Kimpungi et Sanda; ainsi que T. congolense Savannah, T. brucei, T. congolense Forest et T. vivax chez Glossina palpalis palpalis à Kimpese. Pour ce qui est des glossines, les auteurs ont identifié G. tabaniformis et G. fuscipes à Mushie dans le Mayi Ndombe et à Idiofa au Kwilu, G. fuscipes quanzensis à été mis à évidence à Kinshasa, et G. palpalis palpalis a été capturé à Nomgwa, Kamba, Kimpese et Kolo au Kongo Central. Un programme national de lutte contre la TAA devra être mis en place pour parvenir à contrôler cette pathologie pour éviter des pertes économiques aux éleveurs.
Mots clés: TAA, RDC.
Téléchargements
Publié-e
Comment citer
Numéro
Rubrique
Licence

Revue Marocaine des Sciences Agronomiques et Vétérinaires est mis à disposition selon les termes de la licence Creative Commons Attribution - Pas d’Utilisation Commerciale - Partage dans les Mêmes Conditions 4.0 International.
Fondé(e) sur une œuvre à www.agrimaroc.org.
Les autorisations au-delà du champ de cette licence peuvent être obtenues à www.agrimaroc.org.

