Modulation de l’expression des gènes de rédoxines par interférence ADN chez le blé
Résumé
Les modifications génétiques constituent une innovation importante dans l’étude des gènes et des protéines. L’implication des perorédoxines (Prxs) et des thiorédoxines (Trxs h) a été étudiée in planta par voie transgénique dans certains travaux qui ont confirmé leurs rôles dans la protection contre le stress, dans la modulation des protéines de réserve, l’amélioration de la viscosité de la pâte et la diminution des effets négatifs comme l’allergénicité. Chez les céréales, les travaux qui traitent les implications de ces protéines sont encore rares et principalement dans l’amélioration de la qualité germinative. Les techniques disponibles nous offrent deux possibilités de moduler l’expression d’un gène, l’imbibition et la surexpression. La technologie ARN antisens a été utilisée comme moyen pour la régulation de l’expression génique dans un grand nombre d’organismes. Depuis l’avènement de l’interférence ARN (RNAi), cette technique s’est peu à peu imposée par sa simplicité et son efficacité. Elle est devenue un outil puissant pour la détermination des fonction des gènes. Pour notre part, nous nous situerons dans la voie ouverte par des auteurs qui ont apporté une nouvelle souplesse à la technique d’interférence en utilisant des fragments d’ADN au lieu des fragments d’ARN double brin. Pour obtenir le fragment d’ADN, un couple de primers suffit. Dans cette étude, en nous basant sur les données de la littérature, nous avons mis au point une méthode simple à mettre en œuvre et efficace pour inhiber l’expression des gènes ciblés (Trx h1, h2, h3 et Grx) par interférence ADN. Ceci est réalisé après injection soit du gène entier soit des petits fragments d’ADN double brin d’une vingtaine de pair de bases sur le modèle des siARN. L’inhibition de l’expression des gènes, à un effet sur le développement des plantules.
Mots clés: Blé, inférence ADN, rédoxines
Téléchargements
Introduction
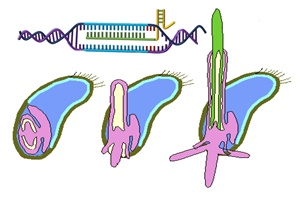
La génétique inverse est devenue une approche de choix pour identifier le rôle de certains gènes impliqués dans le développement des plantes et dans l’élaboration de la qualité de la matière première. La technologie basée sur l’interférence par ARN (RNAi) en est l’exemple le plus emblématique. Le principe consiste à introduire des fragments d’ARN double brin dans un organisme ou une cellule. La figure 1 montre le mécanisme d’interférence ARN.
Les molécules d’ARN double brin sont d’abord découpées par une RNase double brin, l’éminceuse (Dicer) produisant des fragments d’environ 21-23 nucléotides, les petits ARN interférant (short interfering RNA, siRNA). Ces petits ARN sont ensuite incorporés sous forme de simple brin dans un complexe ribonucléoprotéique (RISC) où ils servent de guide pour la reconnaissance de la cible. L’interférence a lieu quand l’un des brins est susceptible de s’hybrider de manière spécifique avec un ARNm pour induire la suppression de l’expression génique de cette cible. Cette inhibition peut donc avoir lieu au niveau du cytosol par dégradation de l’ARNm ou par inhibition de la traduction (Hannon et al., 2002; Vaucheret et al., 2001). L’un des avantages de ce procédé, est qu’il n’est pas restreint à une cellule mais s’étend aux cellules voisines grâce aux petits ARN eux même (Dunoyer et al., 2010). Ainsi, il n’est pas nécessaire d’avoir une intégration stable d’un transgène, car une expression transitoire est suffisante pour induire le phénotype correspondant à l’inhibition de l’expression génique.
Quelques travaux avaient ouvert cette voie en montrant que des ADN double brin, dépourvus de promoteur, pouvaient induire l’inhibition de l’expression génique chez les plantes (Voinnet et al., 1998; Palauqui et al., 1999; Rutherford et al., 2004, Nowak et al., 2009).
Des équipes, surtout dans le milieu médical, montrent un intérêt grandissant pour les systèmes à base d’ADN. Ce travail s’inscrit dans ce sens, puisqu’il consiste à inhiber trois gènes (deux thioredoxines (Trx h) et une glutarédoxines (Grx) au stade plantule du blé. Il s’agit de déterminer si l’on pouvait mettre en évidence au niveau de l’expression des gènes et au niveau phénotypique un possible effet de l’inhibition. Ainsi si on pouvait évaluer en deuxième lieu la redondance et/ou la spécificité des isoformes de la Trx h. Cette étude s’inscrit dans l’optique d’une compréhension de la qualité germinative du blé tendre en particulier et des céréales en générale, par le biais de marqueurs et principalement les rédoxines. Par leurs multiples fonctions dans les processus de germination comme la mobilisation des protéines de réserve, et la protection contre le stress oxydatif, les protéines des rédoxines semblent être les biens placés pour aborder la qualité germinative.
Pour atteindre ces objectifs et en s’appuyant sur les données de la littérature, une méthode simple a été mise au point pour inhiber l’expression des gènes ciblés (Trx h1, h2, h3 et Grx) par interférence ADN en utilisant l’injection du gène entier ou de petits fragments d’ADN double brin de séquence spécifique à la cible.
L’analyse phénotypique a été faite par le suivi du développement des plantules et l’expression des gènes, par qRT-PCR à partir des ARN totaux et l’expression des protéines de Trx h par westren blot.
Matériels et méthodes
Matière végétale
Une centaine de grains de blé Soissons placés dans un Falcone de 50 ml sont trempés dans de l’hypochlorite de sodium à 10% pendant 20 à 30 minutes. Ensuite ils sont lavés 3 fois dans de l’eau stérile puis une fois dans une solution d’acide chlorhydrique (10 mM). Ils sont finalement lavés 5 fois avec de l’eau stérile. Les grains sont semés en condition stérile c’est-à-dire sur papier filtre wattman humide dans des boites de Pétri et ils sont mis à germer dans un phytotron (Fisher bioblock Scientific), entre 72-96 heures sous 200 µmol. m-2. s-1, avec une photopériode de 16 h et un gradient de température jour/nuit de 23/20°C. Les graines germées sont ensuite transplantées à raison de quatre unités par pot dans un terreau commercial stérile. Avant l’ouverture de la première feuille (environ quatre jours de germination), 5 µl de la solution d’interférence, siADN ou de l’eau stérile sont injectées dans la première feuille, elles sont replacées dans le phytotron. L’expression des gènes de Trx h1, Trx h2, Trx h3 et Grx est analysée à 8 h, et à 96 h.
Préparation de l’ADN interférant
Gènes de thiorédoxines et de glutarédoxines (geADN)
Les transcrits des Trx h1 (AY072771), Trx h2 (AF286593), Trx h3 (AF420472) et Grx (EU823285) du blé tendre (Triticum aestivum, cv Soissons) sont amplifiés par PCR. L’amplification est réalisée à l’aide de 2 unités de la polymérase pfu (Promega) dans un tampon commercial (Promega), avec 200 µM de chaque dNTP, 0,5 µM de chaque amorce et 1 ng d’ADN dans volume final de 25 µl. Les amorces sont indiquées dans le tableau 1.
La PCR est réalisée dans un thermocycleur Applied BioSystems 9700 dans les conditions suivantes: 1 cycle à 95°C pendant 3 minutes; 30 cycles à 95°C pendant 30 secondes, 60°C pendant 30 secondes; 1 cycle. Les échantillons contenant les amplicons de Trx h1, Trx h2, Trx h3 et Grx sont analysés par électrophorèse sur gel d’agarose 1%. Les bandes de 400 bp qui correspondent aux ADN des Trx h1, Trx h2, Trx h3 et Grx sont alors coupées et purifiées par le Kit de purification Qiagen dans un volume de 10 µl.
Les petites ADN double brin (siADN)
Les petits ADN double brin (siADN) ont été dessinés par le programme SiRNA (bioweb2.pasteur.fr) à partir de la séquence ARNm. Les solutions (50 µM) de siADN ont été préparées par hybridation des amorces correspondantes (Tableau 2) avec leur brin complémentaire dans un thermocycleur par un gradient de température de 90°C à 40°C pendant 15 minutes.
La quantification relative de l’expression génique par PCR en temps réel
L’extraction d’ARN a été réalisée suivant les instructions décrit par le kit RNAesay Plant mini Kit (Promega). Les gènes des Trx h1 (AY072771), Trx h2 (AF286593), Trx h3 (AF420472) et Grx (EU823285) du blé tendre (Triticum aestivum, cv Soissons) sont amplifiés par PCR. L’amplification est réalisée à l’aide de 2 unités de la polymérase pfu (Promega) dans un tampon commercial (Promega), avec 200 µM de chaque dNTP, 0,5 µM de chaque amorce et 1 ng d’ADN dans volume final de 25 µl. La PCR est réalisée dans un thermocycleur Applied BioSystems 9700 dans les conditions suivantes: 1cycle à 95°C pendant 3 minutes; 30 cycles à 95°C pendant 30 secondes; 60°C pendant 30 secondes; 1 cycle à 72°C pendant 7 minutes. La quantification relative d’un gène donné est exprimée, après normalisation par l’expression de l’ARNr 18S (5’-AGTAAGCGCGAGTCATCAGCT3’; 5’-CATTCAATCGGTAGGAGCGAC-3’) utilisé comme contrôle interne, en pourcentage de l’expression d’une référence par la méthode du 2-ΔΔCT (Livak et al., 2004).
Analyse par western blot
Des graines de blé sont mises à germer dans des conditions stériles. A la sortie de la première feuille, 5 µl des siADN de la Trx h1, de la Grx et le mélange équimolaire des Trx h (Trx h1, h2 et h3) ont été injectés. Des témoins positifs en injectant de l’eau stérile et des témoins négatifs sans aucune injection ont été également préparés. Des prélèvements ont été réalisées à différents moments de la germination (24 h, 48 h, 72 h et 96 h), et les protéines sont extraites dans un tampon contenant 50 mM Tris-Hcl (pH 8), 1 mM d’EDTA et 0,5 mM de PMSF. Les protéines sont ensuite concentrées grâce à un évaporateur concentrateur. 35 µg de protéines ont été utilisées pour réaliser des analyses western blot. L’expression des protéines de la Trx h1, a été suivie en utilisant des anticorps Anti-Trx h2 du pois (Pisum sativum), couplés avec des anticorps antiRabbit Ig G (sigma). La révélation a été réalisée grâce au substrat (Sigma FASTTM 5-Bromo-4-chloro-3indolyl phosphate/Nitro Blue Tetrazolium Tablets).
Résultats
L’expression des gènes
L’expression des gènes a été analysée par qRT-PCR en temps réel à partir des ARN totaux du matériel végétal. L’expression est mesurée à 8 h et 96 h en faisant l’hypothèse que ce mode d’inférence génère au moins une inhibition temporaire. Ceci permettra d’évaluer ainsi la durée de vie de cet effet. Le profil d’expression des gènes cibles chez les plantules témoins montre que, dans les conditions de l’expérience, la Trx h1 est la plus exprimée, Trx h2 et h3 ont un niveau d’expression similaire et supérieure à celle de la Grx (Figure 1).
Inhibition par Trx h1
L’analyse de l’expression des gènes après une injection de Trx h ou de Grx sous la forme geADN ou siADN montre que ce système est susceptible de générer une modulation de l’expression du gène en question mais il module également celle des autres gènes ciblés. Ainsi, l’interférence par la Trx h1 sous la forme de siADN induit une inhibition quasi complète du gène 8 h après le traitement ainsi qu’à 96 h. La Trx h1 siADN induit également une inhibition complète des autres gènes ciblés après 8 h, par contre on observe une faible reprise de l’expression des ces derniers à 96 h et en particulier pour la Grx (Figure 2 et 3). Le traitement par geADN montre un profil différent. L’inhibition de Trx h1 atteint 75% à 8 h et n’est plus qu’à 65% à 96 h, indiquant un contournement de l’interférence, contrairement à ce qui est observé avec le siADN.
Parmi les autres particularités, l’expression de Trx h3 reste inhibée à 90% même à 96 h, et par conséquent, l’effet de l’interférence semble plus efficace sur Trx h3 que sur Trx h1. La Grx a un profil similaire à celui de laTrx h1 tandis que l’expression de laTrx h2 est la moins affectée par cette méthode avec 20% d’inhibition.
Inhibition par Trx h2
L’injection de Trx h2 induit un profil d’inhibition similaire à ce qui a été observé précédemment avec quelques particularités (Figure 4 et 5).
En premier lieu, l’efficacité de l’inhibition par geADN est plus grande qu’avec la Trx h1 et est quasiment du même ordre que celle du siADN. On constate l’inhibition totale à 8 h et un début de contournement de l’interférence à partir de 96 h. L’essai d’inhibition par injection de Trx h3 donne également le même profil (résultat non montré).
De ces trois essais d’inhibition, celle avec le siADN de la Trx h1 est la plus efficace, non seulement sur la Trx h1 mais aussi sur les autres gènes cibles. Ces résultats font partie d’un certain nombre d’indices qui plaident en faveur d’un rôle particulier de ce gène par rapport aux deux autres.
Inhibition par Grx
L’injection de la Grx sous la forme siADN à la particularité de provoquer l’inhibition totale des 3 Trx h jusqu’à 96 h, tandis que l’on observe un début de la phase de contournement à 96 h (Figure 6 et 7).
L’effet de l’interférence de Grx sur la synthèse des Trxs h et le contrôle de l’inhibition pour Grx sont confirmés par la forme geADN dans la mesure où à 96 h, l’inhibition n’est plus que de 25%. L’inhibition par le mélange équimoléculaire des différents interférents ainsi qu’un volume de 15 µl de Grx ont le même effet, c’est-à-dire une inhibition totale de la synthèse de tous les gènes, ce qui est corrélé avec l’arrêt du développement de la plantule.
Expression des protéines des Trx hs
Les résultats de l’expression des protéines des Trx hs obtenus par western blot grâce à l’anticorps anti-Trx h2PS (Pisum sativum), ne montre pas une inhibition de l’expression des protéines aussi importante qu’après injection des siADN des Trx h1, du mélange équimolaire des Trx h (h1, h2 et h3) et de Grx (Figure 8A, B et C). Il s’agit d’une très légère inhibition pendant les premières 48 h qui suivent les injections (Figure 9A et B), avant que cette expression ne retrouve son niveau des échantillons témoins. Les anticorps antiTrx h2PS ont été utilisés, car ils reconnaissent d’une manière spécifique les protéines recombinantes des Trx h1, h2 et h3 (Figure 8).
Analyse phénotypique
Les plantules du blé (cv Soissons) retenues dans l’expérimentation ont été choisies sur la base de leur homogénéité phénotypique. Les essais (geADN, siADN) et les témoins (H20) sont traités et le développement des plantules a été suivi au-delà de 96 h. D’une manière générale, on observe que les essais ont un développement normal comparé aux témoins, mais leur croissance est un peu plus lente. La croissance, évaluée sur la base de celle de la première feuille, est d’autant plus lente qu’on est proche de t=0 de l’injection. On note par exemple qu’une interférence par geADN de la Trx h1 génère une différence de 2-3 cm entre le témoin et l’essai 72 h après traitement (Figure 10). Le traitement par siADN a un effet plus inhibiteur de la croissance que celui par geADN. Après 96 h et lors d’une injection de 5 µl, qui est celle qui a été retenue lors de la mise au point de la méthode, les plantules essais deviennent peu à peu indiscernable par rapport aux témoins.
Si après 96 h, on transfère les deux types de plantules dans un phytotron dans les mêmes conditions, mais avec un gradient de température jour/nuit de 37°/28°C, on constate que les plantules des essais ont un phénotype pâle par rapport aux témoins. Cela signifie que les effets de l’inhibition sont encore perceptibles après 96 h. Cependant, les plantules retrouvent rapidement le phénotype des témoins. Les observations montrent également que le phénotype des plantules varie en fonction de la nature et de la dose des solutions d’interférence. Ces résultats préliminaires montrent que les méthodes d’inhibition par geADN et siADN des Trxs h et de la Grx, comme utilisées dans cette étude, sont capables d’affecter d’une manière limitée le développement de la plantule. En outre, elles suggèrent un lien direct ou indirect entre l’expression de ces gènes et l’intégrité de l’appareil foliaire mise en évidence par le stress thermique, et dans une certaine mesure, la dose d’interférant ou l’interférence multiple.
Discussion
Les résultats préliminaires obtenus grâce à ces expériences ont un effet sur les plantules causé par l’interférence ADN. Cependant, la méthode développée nécessite une étude plus approfondie. L’injection des siADN et des geADN montre une extinction de l’ensemble des gènes de rédoxines étudiées (thiorédoxines h et glutarédoxine). Cela rend difficile l’interprétation des résultats en particulier quant à la spécificité des interférant vis-à-vis de leur cible. Il semble que l’ADN interférant reconnaît une multitude d’ARNm. Ainsi, pour confirmer ces résultats et valider la méthode mise en place, l’injection contrôle d’ADN («si» ou «ge») ciblant un gène absent du génome de l’organisme étudié (i.e. gène codant la Green Fluorescent Protein) semble indispensable. Malgré ce manque, une interprétation de ces résultats préliminaires peut être réalisée. On observe ainsi, une plus grande efficacité des siADN par rapport aux geADN à inhiber l’expression des gènes cibles.
Dans les conditions de cette expérimentation, en dépit du choix des séquences utilisées pour générer les phénomènes d’interférences, il est difficile d’inhiber un gène unique dans les conditions utilisées. Ceci peut être dû à la proximité des séquences des isoformes. En retournant l’argument, cette technique offre donc la possibilité d’inhiber une famille génique telle que les Trx ou les Grx à l’aide d’un unique siADN.
Au contraire de l’effet de l’inhibition des transcrits des rédoxines par les siADN, l’inhibition de l’expression des protéines n’est pas aussi importante que les gènes des rédoxines étudiés. Le maintien de l’expression des protéines, peut être expliqué par le turn-over plus lent des protéines, ou encore que d’autres isoformes de Trxs h compensent la synthèse des protéines des Trxs h. Il faut signaler que l’anticorps anti-Trx h2PS, ne révèle la présence que d’une seule bande de Trx h dont les gènes sont inhibés. Ce qui rend difficile le suivi de l’expression de chaque protéine. Ainsi, le suivi de l’expression des protéines nécessiterait certainement, l’utilisation des anticorps spécifiques pour chaque protéine de Trxs h.
Cette étude avait également pour objectif de répondre à la question de la possibilité de mettre en évidence un effet phénotypique de l’inhibition de Trxs h par interférence. En effet, des travaux similaires entrepris sur Arabidopsis ont montré qu’apparemment, l’inhibition sélective de Trx h n’avait aucun effet phénotypique (Yves Meyer, communications personnelles). Cette absence d’effet pouvait être interprétée par une réaction de compensation due au nombre d’isoformes de la Trx h chez Arabidopsis.
Concernant le blé, et les céréales en général, une surexpression de Trx h au niveau du grain chez l’orge (Wong et al., 2004) ou une inhibition par la technologie anti-sens de la Trx h chez le blé (Guo et al., 2007) avait des effets mesurables sur la germination et la taille des agrégats protéiques. Ceci montre que la modulation de l’expression des Trxs h au niveau du grain est mesurable en termes physiologiques. Dans ces travaux, nous montrons que l’inhibition de Trx h ou de Grx induit un retard très limité dans le développement.
Elle se traduit en outre par une vulnérabilité au stress oxydatif généré par un stress thermique. Les Trxs h et les Grxs en particulier sont connues dans le maintien de l’état redox intracellulaire, et leur potentiel comme facilitatrices et régulatrices de la conformation de protéines et d’activité chaperonne (Berndt et al., 2008). Il ne serait pas étonnant que l’inhibition de ces censeurs de l’état redox cellulaire ait des conséquences sur le métabolisme en général.
La première donnée de ces résultats préliminaires, et si ce résultat sera confirmé lors de l’utilisation de contrôles externes, est l’impact de l’inhibition de la Grx sur celle des Trxs h. Les Grxs cytosoliques réduit les protéines glutathionylées et interviennent dans le maintien du statut redox des protéines pendant un stress oxydatif. Une étude récente montre qu’une inhibition de la Grx1 aggrave le disfonctionnement mitochondrial dans un modèle animal de maladie neurodégénérative, telle que la maladie de Parkinson. La Grx1 intervient donc dans le maintien de l’intégrité de la membrane externe de la mitochondrie (Saeed et al., 2008). Des fonctions similaires peuvent être évoquées dans le présent cas. On connaît également un cas où la Trx h est réduite par le système GSH/Grx (Gelhaye et al., 2003). Les résultats suggèrent une évidente dépendance des Trx h étudiées par rapport à la Grx, par conséquent les cas de réduction de la Trx h par la Grx/GSH doit être plus répandue qu’on ne le croit.
L’inhibition observée avec les gènes montre que ce système est fonctionnel. L’inhibition observée par le biais de geADN suggère que le double brin ADN est susceptible d’être reconnu par l’équivalent de la RNase Dicer (Montrichard et al., 2003; Nowak et al., 2009), enzyme très conservée chez les champignons, plantes, mammifères, nématodes et insectes (Serrato et al., 2001). Il doit être ensuite découpé en petits siADN, et ceux-ci sont enfin incorporés sous forme simple brin dans le complexe ribonucléoprotéique dénommé RISC (RNA-induced silencing complex) où ils servent de guide pour la reconnaissance de la cible (Hammond et al., 2000). L’action des siADN est beaucoup plus marquée que celle des geADN et mériterait d’être comparé à celle des siARN pour évaluer leur différence.
Conclusion
Dans cette étude, en nous basant sur les données de la littérature, nous avons mis au point une méthode simple à mettre en œuvre et efficace pour inhiber l’expression des gènes ciblés (Trx h1, h2, h3 et Grx) par interférence ADN. Ceci est réalisé après injection soit du gène entier soit des petits fragments d’ADN double brin d’une vingtaine de pair de bases sur le modèle des siARN. L’inhibition de l’expression des gènes, à un effet sur le développement des plantules. Cet effet reste limité dans le temps, puisque les plantules retrouvent rapidement un développement identique aux plantules témoins.
Les résultats obtenus sont encourageants, mais pour valider définitivement ces résultats et donc la méthode développée, d’autres travaux sont nécessaires. D’abord, une répétition de l’expérience en suivant l’expression d’autres gènes que les rédoxines pour s’assurer que les siADN et/ou les geADN ciblent bien l’ARNm du gène en question. Cela permettrait de confirmer ou d’affirmer les interactions observées entre les isoformes de Trx h et entre les Trxs h et la Grx. Toujours dans le cadre de vérifier l’efficacité de cette méthode dans l’inhibition de l’expression des gènes, une analyse northern blot des petites ARN doit être réalisée. Cela permettrait de confirmer les résultats obtenus par qRT-PCR.
Références
Bashandy, T., Guilleminot, J., Vernoux, T., Caparros-Ruiz, D., Ljung, K., Meyer, Y., Reichheld, J.P. (2010). Interplay between the NADP-linked thioredoxin and glutathione systems in Arabidopsis auxin signaling. Plant Cell, 22: 376-391.
Berndt, C., Lillig, C.H., Holmgren, A. (2008). Thioredoxins and glutarédoxines as facilitators of protein folding. Biochimica and Biophysica Acta, 1783: 641-650.
Dunoyer P., Schott G., Himber C., Meyer D., Takeda A., Carrington J.C., Voinnet O. (2010). Small RNA duplexes function as mobile silencing signals between plant cells.
Science, 328: 912-916.
Gelhaye, E., Rouhier, N., Jacquot, J.P. (2003). Evidence for a subgroup of thioredoxin h that requires GSH/Grx for its reduction. FEBS Letters, 555: 443-448.
Hammond, S.M., Berstein, E., Beach, De., Hannon, G.J. (2000). An RNA-directed nuclease mediates post-transcriptional gene silencing in Drosophila cells. Nature, 404: 293-296.
Hannon, G.J. (2002). RNA interférence. Nature, 418: 244-251.
Livak, K.J., Schmittgen, T.D. (2001). Analysis of relative gene expression data using real-time quantitative and the 2T- C method. Methods, 25: 402-408.
Montrichard, F., Renard, M., Alkhalfioui, F., Duval, F.D., Macherel, D. (2003). Identification and differential expression of two thioredoxin h isoforms in germinating seeds from pea. Plant Physiology, 132: 1707-1715.
Nowak, M., Woszko, E., Fedoruk-Wyszomirska, A., Pospieszny, H., Barciszewska, M.Z., Barciszewski, J. (2009). A new and efficient method for inhibition of RNA viruses by DNA interference. FEBS Journal, 276: 4372-4380.
Palauqui, JC., Balzergue S. (1999). Activation of systemic acquired silencing by localised introduction of DNA. Current Biology, 9: 59-66.
Rutherford, G., Tanurdzic M., Hasebe M., Banks J.A. (2004). A systemic gene silencing method suitable for high throughput, reverse genetic analyses of gene function in fern gametophytes. BMC Plant Biology, 4:1-10.
Saeed, U., Durgadoss, L., Valli, K., Joshi, D., Joshi, P., Ravindranath, V. (2008). Knockdown of Cytosolic Glutaredoxin 1 Leads to Loss of Mitochondrial Membrane Potential: Implication in Neurodegenerative Diseases. PLoS One, 3: e2459.
Voinnet, O., Vain, P., Angell, S., Baulcombe, D.C. (1998). Systemic spread of séquence-specific transgene RNA degradation in plants is initiated by localized introduction of ectopic promoterless DNA. Cell, 95: 177-187.
Wong, J.H., Cai, N., Tanaka, C.K., Vensel, W.H., Hurkman, W.J., Buchanan, B.B. (2004). Thioredoxin reduction alters the solubility of proteins of wheat starchy endosperm: An early event in cereal germination. Plant and Cell Physiology, 45: 407-415.
Publié-e
Comment citer
Numéro
Rubrique
Licence

Revue Marocaine des Sciences Agronomiques et Vétérinaires est mis à disposition selon les termes de la licence Creative Commons Attribution - Pas d’Utilisation Commerciale - Partage dans les Mêmes Conditions 4.0 International.
Fondé(e) sur une œuvre à www.agrimaroc.org.
Les autorisations au-delà du champ de cette licence peuvent être obtenues à www.agrimaroc.org.

