Etude rétrospective (1998-2013) des maladies tumorales lymphoblastiques aviaires au Maroc
Résumé
La présente étude rétrospective avait pour objectif d’apporter une mise au point sur la situation des maladies néoplasiques aviaires au Maroc et à répertorier les différents épisodes de leur apparition durant la période de 1998 à 2013, en se 7-8basant sur les données collectées au niveau de l’Unité d’Histologie et d’Anatomie Pathologique du Centre Hospitalier Universitaire Vétérinaire de l’Institut Agronomique et Vétérinaire Hassan II (CHUV-IAV), et auprès de 3 vétérinaires praticiens avicoles. Les résultats de l’analyse réalisée sur un total de 189 cas répertoriés (1 cas = 1 élevage affecté) entre 1998 et 2013 ont montré que les maladies tumorales aviaires continuaient à sévir dans le pays durant la période d’étude. Parmi celles-ci, la maladie de Marek (MD ; Marek disease) constituait 90% des cas étudiés dont 37% se sont déclarés entre la seule période 2004 et 2006. Alors que les leucoses/sarcomes aviaires n’ont intéressé que 10% des cas (tous entre 1998 et 2000) et un cas de myxosarcome en 2008. La MD était plus rencontrée chez les poules pondeuses (69% des cas) que chez les reproducteurs (31% des cas) et affectait le plus fréquemment la tranche d’âge de 19 à 36 semaines aussi bien chez les reproducteurs que chez les poules pondeuses avec respectivement des fréquences de 67% et 58% des cas. La forme clinique de la MD la plus dominante était la forme viscérale seule (20% des cas) ou associée à la forme nerveuse et cutanée (72% des cas). La forme classique nerveuse quant-à-elle n’a intéressé que 8% des cas. Les leucoses myéloïdes représentaient 69% (13/19) de l’ensemble des cas leucoses/sarcomes diagnostiqués dont 11/13 cas de myéloblastose et 2/13 cas de myélocytomatose. Les leucoses érythroïdes étaient présentes chez 21% des cas, et le myxosarcome dans 1% des cas. Ces leucoses/sarcomes ont été observées avec des fréquences de 74% chez les reproducteurs chair, de 21% chez les poules pondeuses et de 5% chez les poulets de chair. Chez les reproducteurs l’âge des animaux affectés était compris entre 17 et 50 semaines avec un âge moyen d’apparition de ces tumeurs de 31 semaines tandis que chez les pondeuses cet âge moyen était de 27 semaines.
Mots clés: Maladies néoplasiques aviaires, maladie de Marek, leucoses/sarcomes aviaires, Maroc
Téléchargements
Introduction
L’aviculture marocaine s’est développée de manière significative durant les trois dernières décennies. Elle permet de satisfaire la demande croissante des consommateurs marocains en produits avicoles (viandes et œufs) et commence à exporter vers d’autres marchés (FISA, 2014). Malgré ce développement remarquable et la promulgation de la loi 49-99 portant sur la protection sanitaire des élevages avicoles, le secteur avicole a continué de subir les effets d’une panoplie de contraintes entre autres d’ordre sanitaire (FISA, 2014).
Les pathologies touchant les élevages avicoles sont diverses et causent des pertes économiques importantes. Parmi celles-ci, les maladies tumorales aviaires notamment la maladie de Marek ont été décrites au Maroc et associées à des pertes considérables. Dès 1984, Wyffells et El Houadfi ont signalé la gravité de la situation de la maladie de Marek (MD) et avaient recommandé la vaccination pour sa prévention (Wyffels, 1984). Dix ans plutard (1993-94), le Maroc a connu une épizootie due au vvMDV et le vaccin Rispens a été homologué pour faire face à cette nouvelle forme de la MD car l’HVT s’est montré inefficace (Kalai Tlamsani, 1994). Dans la même année, une étude anatomo-pathologique de la MD chez les poules pondeuses a permis de caractériser les différentes formes clinico-pathologiques qui sévissaient dans les élevages (Moqadem, 1994). La maladie reste toujours une préoccupation majeure pour l’industrie de la volaille dans le monde en raison de l’imprévisibilité des épizooties et de la possibilité des échecs des vaccins d’assurer une protection comme une conséquence de l’évolution et l’apparition de souches plus virulentes de MDV (Morrow et Fehler, 2004; Nair, 2018). Par ailleurs, une étude rétrospective des épizooties de leucoses aviaires survenues au Maroc de 1998 à 2000 et liées à l’émergence d’un nouveau sous-groupe ALV-J avait montré la prédominance des leucoses myéloïdes (Kichou et al, 2009).
En dépit des mesures préventives, entre autres la vaccination, des épisodes de ces maladies néoplasiques continuaient d’être relevés au Maroc chaque année. Ainsi, la présente étude rétrospective avait pour objectif d’apporter une mise au point sur la situation des maladies tumorales aviaires dans le pays, de mettre en exergue les différents épisodes ou phases d’apparition de ce groupe de pathologies et de déterminer leur principales caractéristiques clinico-pathologiques entre 1998 et 2013.
Méthodologie
La présente étude des maladies tumorales aviaires a concerné 15 années de 1998 à 2013. Les données des registres et collections de cas adressées pour examens anatomopathologiques (macroscopiques et/ou microscopiques) à l’Unité d’Histologie et d’Anatomie Pathologique au sein de l’Institut Agronomique et Vétérinaire Hassan II (UAP-CHUV-IAV) ont été recueillies. A ce niveau, 44 cas de maladies tumorales ont fait l’objet d’analyses histopathologiques par l’UAP-CHUV-IAV dont la majorité a été référée par des vétérinaires praticiens, soit sous forme de prélèvements d’organes atteints (19 cas) ou d’individus vivants présentant des signes cliniques de maladies néoplasiques et/ou qui avaient fait l’objet d’autopsie et de prélèvements d’organes suspects sur place (25 cas). Les collections de lames préparées par les techniques usuelles d’inclusion à la paraffine et colorées par l’hématoxyline et éosine ont été réexaminées pour reprendre le diagnostic déjà établi selon les critères reconnus notamment la distribution des lésions tumorales au niveau des organes et tissus et l’aspect et caractéristiques morphologiques des populations cellulaires néoplasiques (Kichou F. 1999; AAAP, 2013).
Aussi, les données relatives aux cas-élevages atteints de maladies tumorales ont été recueillies auprès de 3 vétérinaires praticiens avicoles. Pour se faire, une fiche de collecte de données sur l’apparition de cas de maladies tumorales aviaires de 1998 à 2013 a été adressée à plusieurs cabinets de vétérinaires praticiens avicoles dont 3 seulement ont répondu favorablement. Cette fiche visait à collecter les données relatives aux caractéristiques de l’élevage (localisation, type de production, capacité exploitée), âge de la bande, la vaccination utilisée contre la MD, les symptômes cliniques, les lésions relevées lors de l’examen nécropsique et le taux de mortalités (calculés en divisant le nombre des mortalités totales déclarées durant la période d’investigation par le vétérinaire traitant sur l’effectif de l’élevage).
Au niveau du premier cabinet vétérinaire CV1, 32 cas de MD ont été recensés en se référant aux fiches d’autopsie, dont la majorité ont été diagnostiquée sur la base des symptômes cliniques (paralysies, parésie, torticolis...) et sur les infiltrations tumorales relevés et leur distribution au niveau des organes. Au niveau des deux autres cabinets vétérinaires CV2 et CV3, les cas collectés ont été de 113 (10 pour CV2 et 103 pour CV3), où les vétérinaires ont rempli eux-mêmes les fiches de collecte de données. Le diagnostic différentiel entre la MD et le groupe des leucoses/sarcomes aviaires était basé sur un ensemble de critères ; l’âge des sujets atteints de lymphomes, le taux de mortalités, les signes cliniques observés, les lésions macroscopiques et leur distribution au niveau des organes. Les mortalités retenues et affichées étaient celles déclarées durant l’apparition des lymphomes et étaient ainsi considérées liées à la maladie tumorale plutôt qu’à d’autres mortalités ou pathologies courantes.
Les données relatives aux cas de maladies tumorales aviaires diagnostiquées au niveau de UAP-CHUV-IAV, ainsi que celle collectées auprès de 3 vétérinaires praticiens avicoles ont été classées par ordre chronologique de 1998 à 2013 dans une base de données numérisée en fichier Excel. Ces données ont fait l’objet d’une analyse afin de comparer les fréquences des différentes maladies néoplasiques et d’étudier leur évolution et leurs caractéristiques principales.
Résultats
Répartition globale des cas de maladies tumorales aviaires
Les principales maladies tumorales affectant la volaille de 1998 à 2013 étaient la MD et les leucoses/sarcomes aviaires. Le nombre des cas MD étaient de 170/189 ce qui représente 90% des cas étudiés (dont 25 cas ont été diagnostiqués sur la base de lésions macroscopiques et microscopiques), alors que pour le groupe des leucoses/sarcomes aviaires le nombre de cas n’était que de 18/189 correspondant à 9% des cas. Un seul cas de myxosarcome (1% des cas) a été diagnostiqué en 2008 (Figure 1).

Évolution dans le temps des cas de néoplasmes aviaires
Les cas de la MD ont été diagnostiqués durant toute la période de l’étude de 1998 à 2013 avec au moins un cas MD chaque année, par contre les cas de leucoses n’ont été observés que durant la période de 1998 à 2000. L’évolution annuelle des cas de néoplasmes aviaires diagnostiqués de 1998 à 2013 par les 3 cabinets vétérinaires est représentée sur la figure 2 et laisse ressortir 5 phases: 1998-2000, 2001-2003, 2004-2006, 2007-2009 et 2010-2013. Selon les cas analysés, la proportion des cas de MD a été de 15% au cours de la phase 1998-2000 pour atteindre le pic de 37% des cas (70/189 cas) durant la phase 2004-2006 puis régresser progressivement durant les phases suivantes. Si l’on considère que la phase 1998-2000, où des cas de leucoses aviaires sont apparus simultanément avec de la MD, ces néoplasmes constituent respectivement 39% (18/46) et 61% (28/46) ce qui dénote que la MD a été toujours la maladie tumorale la plus fréquente et la plus dominante.

Mortalités associés aux cas de néoplasmes aviaires étudiés
Les taux de mortalités indiqués correspondent aux taux obtenus à partir de mortalités communiquées par les vétérinaires traitant lors des épisodes liés aux cas de néoplasmes étudiés et constituaient le motif principal de consultation. Ils variaient entre 0,01% et 45%. Ces taux mortalités rapportées étaient pour certains vétérinaires journaliers (de l’ordre 0,01%, etc…) et pour d’autres correspondaient à des mortalités cumulées pendant la période de consultation et de suivi (de l’ordre de 45%, etc…). Ils ont été classés selon les phases déjà établies pour pouvoir comparer les mortalités avec les pics observés des maladies tumorales aviaires. Durant la phase 1998-2000 le taux de mortalité était de 0,03% pour la MD et 3 pour les leucoses sarcomes aviaires. Pour la MD le taux de mortalité est passé à 0,13% durant la phase 2001-2004 et il est monté à 1,39% durant la phase du pic de la maladie (2004-2006) pour baisser à 0,65% pendant la phase 2005-2009. Cependant, des taux de mortalité très élevés de 45% ont été observés au niveau de deux élevages atteints de la MD en 2012 provenant d’un même couvoir local. Cela explique le taux de mortalité élevé durant la dernière phase de l’étude (2010-2013) et qui était de 11,3% (Figure 3).

Caractéristiques des cas de la maladie de Marek
Fréquence de la maladie de Marek selon le type de production et de l’âge des oiseaux
Les poules pondeuses semblent développer la MD deux fois plus que les reproducteurs, avec une fréquence de 69% (118/170 cas) chez les poules pondeuses contre 31% des cas (52/170) chez les reproducteurs.
L’âge moyen d’apparition des lymphomes, comme recueillis dans les fiches fournies par les 3 vétérinaires traitants, était de 31 semaines chez les reproducteurs alors que chez les poules pondeuses il n’était que de 21 semaines (Figure 4). La plus grande proportion des cas de reproducteurs affectés par la MD avait un âge compris entre 19 et 36 semaines (67%) suivis de ceux entre 37 et 50 semaines avec 27% des cas. Les cas plus jeunes de 9-18 semaines ne constituaient que de 6% (Figure 5). Chez les poules pondeuses la plus grande proportion était pour les sujets en maturité sexuelle, avec 58% qui avait un âge compris entre 19 et 36 semaines, 37% entre 6 et 18 semaines, et 5% pour celles âgées de 37 à 50 semaines (Figure 6).



Nature, localisation et distribution macroscopique et microscopique des tumeurs de cas de maladie de Marek
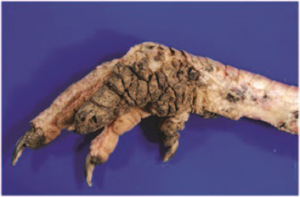
L’étude de la nature, la localisation et la distribution lésionnelle n’a concerné que les 25 cas de MD référés à l’UHAP-CHUV-IAV et sur lesquelles des examens macroscopiques et microscopiques ont été réalisés. Les formes cliniques de la MD rencontrées lors de cette étude lésionnelle étaient la forme viscérale associée à la forme nerveuse chez 48% des cas, la forme viscérale associée à la forme cutanée correspondait à 8% des cas, et les cas qui avaient les trois formes cliniques simultanément (viscérale, nerveuse et cutanée) étaient de 16%. La forme viscérale seule était observée chez 20% des cas et la forme nerveuse seule était présente chez 8% des cas (Figure 7). Les formes nerveuses étaient associées à des signes cliniques dominés par la paralysie des animaux avec signe du «Grand écart»; Photos 1-1 et 1-2.


Aspect macroscopique et microscopique des lésions viscérales de la maladie de Marek
Lésions macroscopiques
Les lésions viscérales rencontrées à l’examen macroscopiques des cas étudiés étaient soit des infiltrations tumorales blanchâtres très révélatrices de la MD associée à une hypertrophie modérée à très marquée des organes atteints notamment le foie, la rate, les reins, le myocarde, la bourse de Fabricius et/ou de la grappe ovarienne (Photos 2 à 9) et l’épaississement de la paroi du proventricule et du duodénum.




Lésions microscopiques
Les lésions viscérales microscopiques rencontrées au niveau des tissus examinés correspondaient à des infiltrations par des cellules tumorales lymphoblastiques polymorphes (lymphocytes, lymphoblastes et plasmocytes) qui pouvaient être petites, moyennes ou grandes, avec des images fréquentes de mitose et la présence de cellules dites de Marek (Microphotos 1 à 6). Des zones de nécrose hépatique, splénique ou rénale ont été aussi décrites.
Chez les cas présentant une forme nerveuse, les lésions macroscopiques consistaient en une hypertrophie des nerfs sciatiques et des plexus lombosacrés et axillaires, avec perte des striations transversales (photos 10, 11). Cette catégorie de lésion était décrite chez 22% des cas étudiés. Mais dans la plupart des cas (78%), ces lésions n’étaient pas observées à l’œil nu.




Les lésions microscopiques rencontrés au niveau des nerfs chez les 78% des cas de MD qui ne présentaient pas des lésions macroscopiques, étaient essentiellement des infiltrations discrètes, modérées ou sévères par une population de cellules lymphoïdes néoplasiques polymorphes. (Microphoto 7). Au niveau du système nerveux central (mésencéphale, bulbe et cervelet), des manchons lymphocytaires péri-vasculaires et infiltrats lympho-gliaux nodulaires et/ou diffus étaient notés dans la plupart des cas (Microphoto 8).

Les lésions macroscopiques cutanées relevées lors des examens nécropsiques sont soit des tumeurs sous cutanées sur la base des plumes avec hypertrophie (50%) soit des formations nodulaires avec des plaques ulcérées localisées ou non sur les follicules plumeux (50%). Les lésions microscopiques rencontrées lors des examens histologiques effectués sur les cas présentant la forme cutanée de la MD sont des infiltrations localisées du derme par des cellules lymphoïdes néoplasiques polymorphes.
Caractéristiques des cas de leucoses/sarcomes aviaires
Les cas de leucoses/sarcomes étaient référés au CHUV-IAV étaient soumis entre 1998 et 2000, avec un cas de myxosarcome qui a été diagnostiqué en 2008. Les leucoses myéloïdes représentaient 69% (13/19) de l’ensemble des cas du groupe des leucoses/sarcomes aviaires dont 11/13 cas présentaient une myéloblastose, et 2/13 cas présentaient une myélocytomatose. Les leucoses érythroïdes étaient diagnostiquées chez 21% des cas, et l’histiosarcome et le myxosarcome dans 5% des cas chacun (Figure 8).

Les cas de néoplasmes appartenant au groupe des leucoses/sarcomes aviaires avaient été observés chez les reproducteurs (74% des cas), chez les poules pondeuses (21%) et chez les poulets de chair (5%). L’âge des reproducteurs chair affectés était compris entre 17 et 50 semaines avec un âge moyen d’apparition des leucoses/sarcomes de 31 semaines; alors que chez les poules pondeuses cet âge moyen n’était que de 27 semaines.
Les lésions macroscopiques rencontrées lors des cas de leucoses/sarcomes aviaires diagnostiquées au sein du CHUV-IAV consistaient à une hypertrophie au niveau des viscères (foie, rate et rein) avec des infiltrations tumorales blanchâtres sur les organes atteints ; foie, rate, testicules, grappe ovarienne, cœur, poumon, bréchet, sternum, et côtes (photos 12 à 15).


Les lésions microscopiques se distinguaient selon le type de leucoses/sarcomes diagnostiqués. Lors de la leucose myéloïde, l’infiltration tumorale des différents organes et tissus était par une population de myélocytes néoplasiques à granulations cytoplasmiques éosinophiles et homogène (Microphoto 11). Alors que la leucose érythroïde se caractérisait par l’infiltration des tissus et espaces sinusoïdes hépatiques et spléniques par une population d’érythroblastes et d’érythrocytes (Microphoto 12) entraînant une érythrostase hépatiques, rénale et splénique. L’histiosarcome se distingue par des cellules histiocytaires néoplasiques fusiformes ou polyédriques et organisées en faisceaux (Microphotos 13 et 14).


Discussion
De 1998 à 2013, 189 cas de maladies néoplasiques ont été répertoriés et analysés ce qui dénote que les maladies tumorales ont occupé une place assez importante en pathologie aviaire au Maroc. Ces chiffres auraient pu être plus élevés si des données supplémentaires avaient pu être recueillies auprès davantage de vétérinaires. Parmi ces maladies néoplasiques prévalentes au Maroc, la MD reste la plus répandue et occupait une place prépondérante (90% pour la MD contre 10% pour le groupe des leucoses/sarcomes aviaires). Si l’on considère uniquement la phase 1998-2000, où des cas de leucoses/sarcomes aviaires et de la MD se sont déclarés simultanément, ces néoplasmes constituent respectivement 39% (18/46) contre 61% des cas (28/46), ce qui dénote que la MD représentait la maladie tumorale la plus fréquente durant la période d’étude.
Parmi le groupe des leucoses/sarcomes, la leucose myéloïde représentait 69% des cas, la leucose érythroïde 21% des cas, et le myxosarcome et l’histiosarcome, chacun 5% des cas. Ceci était lié à l’émergence dans le monde du nouveau sous-groupe ALV-J de leucoses/sarcomes aviaires (Kichou et al., 2009). Depuis que la leucose myéloïde à été diagnostiquée pour la première fois au Maroc entre 1998 et 2000 aucun cas n’a été relevé depuis, ce qui peut être expliqué par l’écartement de souches de reproducteurs importées et qui étaient infectés par ALV-J des leucoses/sarcomes aviaires. En 1998, la plupart des grands parentaux des souches lourdes avaient étés touchés par le ALV-J (Mouahid, 1999) et une grande menace mettait en jeu l’aviculture mondiale. L’éradication du ALV des troupeaux de reproducteurs grands parentaux était le moyen le plus efficace pour contrôler l’infection par l’ALV chez les poulets. Ce fût la première fois dans l’histoire que les grands concurrents sélectionneurs se mettaient autour d’une même table pour décider d’une stratégie commune d’éradication. Ainsi, ces entreprises de sélection des reproducteurs types chair et ponte ont fait des progrès significatifs dans la réduction ou l’éradication des sous-groupes A, B, J de l’ALV de leurs lignées de volaille (Payne, 2012).
L’analyse de l’évolution des cas de MD durant la période d’étude a permis de distinguer 5 phases où les cas de la MD ont été rencontrés,15% des cas signalés entre 1998 et 2000, pour atteindre un pic durant la période 2004-2006 avec 37% des cas, ensuite les proportions ont régressé durant la période 2007-2009 et 2010-2013 où seulement 4% des cas ont été diagnostiqués mais avec des taux de mortalité très élevés durant la dernière phase. Ce type d’évolution est bien connu pour la MD et serait lié à l’alternance de phases de protection vaccinale et d’apparition de nouveaux pathotypes virulents de MDV et leur dynamique dans les élevages (Witter et al, 2005; Kennedy et al., 2017).
Ces recrudescences de cas de la MD sous forme épizootique ou de cas sporadiques ont survenu bien que tous les animaux affectés fussent issus d’élevages vaccinés (vaccin bivalent HVT/Rispens). Il est à signaler que toutes les poules pondeuses touchées par la MD ont été produites et vaccinées au Maroc alors que les poules reproductrices, elles ont été toutes vaccinées et importées de l’étranger: Espagne, France, Hollande, Allemagne (Mouahid, communication personnelle). Les vaccins utilisés contre la MD sont des vaccins anti-tumoraux et non pas anti-virémiques, cela donne aux souches virales une chance de développer plus de virulence comme il a été avancé par plusieurs auteurs (Davison et al., 2004; Schat et Nair, 2008). En effet, des épisodes sporadiques de la MD ont été décrits de temps à autre au Maroc. En 1976, 4% des cas ont été attribué à des tumeurs aviaires parmi les différentes pathologies diagnostiquées au sein du département de Pathologie Aviaire à l’IAV Hassan II et en 1983, 9% des cas ont été atteints (Wyffels et al., 1984). En 1992, la prévalence de la MD était de 4,62% des cas référés au département de Pathologie Aviaire puis 15% des cas en 1993 (Moquadam, 1994).
Les maladies tumorales aviaires causent des pertes économiques importantes au niveau des élevages affectés et qui seraient liées en premier lieu aux mortalités engendrées par ces affections, et à la diminution des performances de production des sujets atteints ce qui influence négativement le rendement des élevages affectés. Lors de l’infection par la MD les mortalités excèdent rarement les 10 à 15% mais elles peuvent aller jusqu’à 70% de mortalités dans des cas sporadiques (Davison et al., 2004), alors que lors d’une infection par les leucoses/sarcomes aviaires les mortalités sont généralement comprises entre 1 et 2% mais peuvent atteindre occasionnellement les 20% (Gavora, 1987). Les saisies occasionnées au niveau des abattoirs constituent aussi une source de pertes pour les producteurs à cause des infiltrations tumorales. Un taux moyen de saisies liées à la MD aux États Unis a considérablement diminué, tombant à moins de 0,001% dans la plupart des régions de ce pays en 2002, mais dans certaines régions des taux de saisies plus élevés ont été signalés comme c’était le cas de Delmarva en 2005 (Morrow, et al., 2004).
Les taux de mortalités enregistrés lors de la présente étude sur les maladies tumorales aviaires étaient compris dans un intervalle de 0,01 à 45%, sachant que tous les élevages étudiés ont été vaccinés contre la MD avec un vaccin bivalent (Rispens+HVT). Dans les conditions marocaines, les causes les plus probables de ces taux élevés d’atteinte seraient le non respect des procédures de vaccination au couvoir , le manque d’hygiène dans les élevages ou la pratique d’élevage avec des âges multiples. Ces taux de mortalités élevés peuvent être expliqués également, soit par une infection précoce des animaux, soit par l’apparition d’une ou plusieurs souches MDV plus virulente qui aurait échappé à la vaccination ou par le non respect des normes de biosécurité au sein des élevages. En effet, des récurrences sporadiques de MD se produisent dans des fermes individuelles ou à l’échelle de régions et plusieurs rapports ont accrédité l’implication d’isolats MDV exceptionnellement virulents dans les échecs de vaccination en Europe et en USA (Barrow, 1999; Calnek, 1998; Witter, 1997). Sur la base des taux de mortalité et de morbidité chez les animaux inoculés avec MDV, cinq pathotypes MDV ont été définis : atténué (aMDV), légèrement virulent (mMDV), virulent (vMDV), très virulent (vvMDV) et très virulent plus (vv +MDV) (Witter, 1997). En outre, les vaccins appliqués peuvent contribuer à l’augmentation de la virulence du MDV sur le terrain, comme le montre l’isolement de souches présentant un pouvoir pathogène plus élevé, même chez les oiseaux vaccinés avec la souche CVI988 (Nair, 2005). Une analyse moléculaire différentielle du virus vaccinal et du MDV virulent chez les poulets atteints est très utile dans le diagnostic de la MD et la détermination des causes d’échec de vaccination. Un test PCR quantitatif en temps réel basé sur le polymorphisme d’un seul nucléotide sur le gène pp38, a été développé pour distinguer le MDV du vaccin et le MDV virulent (Baigent et al., 2016) et, est actuellement utilisé en routine pour le contrôle de la qualité de la vaccination dans les couvoirs.
Les vaccins MD sont très efficaces pour prévenir le développement clinique des tumeurs, l’immunosuppression et la paralysie liée à l’infection par le MDV (Boodhoo et al., 2016) et ont permis une croissance durable de l’industrie avicole au cours des cinq dernières décennies (Biggs et Nair, 2012). Cependant, les vaccins MD actuels ont un effet limité sur l’infection virale et la transmission et par conséquent, les oiseaux vaccinés continuent d’être infectés et de transmettre le virus à l’environnement, ce qui favorise l’évolution du MDV vers une virulence accrue (Gimeno, 2008). Le contrôle de la maladie est principalement atteint par la vaccination en utilisant des vaccins vivants atténués, bien que les améliorations génétiques de la résistance de volaille aient également été un élément important dans cette lutte. Malgré le succès global de la politique de vaccination dans le contrôle de la DM au cours des 40 dernières années, l’évolution continue de la virulence et l’émergence de pathotypes recombinants hypervirulents restent le défi majeur pour un contrôle durable de cette maladie (Nair, 2018; He et al., 2018). Par ailleurs, le contrôle de la maladie de Marek passe aussi et surtout par la maîtrise des autres pathologies immunodépressives qui empêchent et/ou retardent la prise immunitaire des vaccins Marek ou alors prédisposent précocement aux infections tumorales. L’exemple de l’interaction du virus de la bursite est le plus anciennement connu (Sharma, 1983) ou plus récemment celui de l’anémie infectieuse (Calnek et al., 2000).
L’étude de la MD selon le type de production a montré que les poules pondeuses ont développé la maladie de Marek deux fois plus que les reproducteurs alors que les cas de leucoses/sarcomes aviaires avaient une distribution contraire; les poules pondeuses développaient moins de lymphomes que les reproducteurs. La MD peut se produire au niveau des élevages dès l’âge de 3 à 4 semaines mais le plus souvent elle est exprimée chez les sujets entre 12 et 30 semaines (Davison et al., 2004), ce qui concorde avec les conclusions tirées de la présente étude, où 58% des poules pondeuses étaient atteintes à un âge compris entre 19 et 36 semaines et 37% avec un âge compris entre 6 et 18 semaines avec un âge moyen de 21 semaines. Chez les reproducteurs, l’âge d’apparition de la maladie était compris entre 19 et 50 semaines avec une moyenne de 31 semaines. En effet, l’âge de l’apparition de la maladie est strictement lié à l’âge de l’infection de l’animal, si des poussins sont infectés aux premiers jours de leur vie, ils seront prédisposés à l’apparition précoce de la maladie que les poussins infectés tardivement (Calnek et al., 2001). La MD survient vers l’âge de 12 à 24 semaines notamment dans sa forme aiguë lymphomateuse, tandis que dans sa forme classique paralytique l’âge de prédilection est entre 4-48 semaines et la maladie peut évoluer et s’étaler jusqu’à 72 et 90 semaines (Payne et Venugopal, 2000; Schat et Nair, 2008; Jayalakshmi et Selvaraju, 2016).
Normalement tous les sujets s’infectent par le MDV avant la troisième semaine d’âge d’où la raison de la vaccination au premier jour ce qui revient à une course entre le virus sauvage et le virus vaccinal. Une fois infectés, les oiseaux hébergent le MDV sous forme intégrée au génome des lymphocytes T CD4+ et plus précisément au niveau de leur télomères (Telomere-integrated MDV) où le virus reste latent jusqu’à réplication (Nair, 2013; Robinson, 2014). Le plus souvent sous l’effet d’un stress (transfert, transport, montée des hormones femelles, etc…) la cellule infectée commence sa multiplication et c’est ce que la recherche essaie de déterminer actuellement.
Les cas de leucoses/sarcomes aviaires se produisent rarement avant l’âge de 14 semaines, et ils sont fréquemment retrouvés chez des sujets âgés entre 14 et 30 semaines (Kanter, 1988), qui est en accord avec les résultats trouvés, où l’âge moyen des animaux étudié était de 31 semaines chez les reproducteurs et 27 semaines chez les poules pondeuses.
Lors de la présente étude, les cas présentés à l’Unité d’Histologie et d’Anatomie Pathologique au CHUV-IAV Hassan II, la forme viscérale de la MD associée ou non avec la forme nerveuse était la plus fréquente. Ceci est en accord avec ce qu’a été rapporté par Payne et al .(2000) qui a décrit la forme aiguë de la MD par la présence de lymphomes au niveau viscéral, et la forme classique par des signes cliniques paralytiques et des lésions essentiellement nerveuses avec absence de lésions viscérales. Histologiquement, les nerfs étaient infiltrés par une population lymphoblastique polymorphe qui sont du même type d’infiltrations cellulaires décrites pour la MD par Lawn et Payne (1979). Les lésions du système nerveux central consistaient en la présence de manchons lymphocytaire péri-vasculaires au niveau du mésencéphale, cervelet et du bulbe rachidien, avec gliose nodulaire ou diffuse comme ils ont été décrits par Gimeno et al. (2001). Les lésions cutanées décrites chez les cas présentant la MD étudiés, étaient sous forme de nodules tumoraux de taille variable ulcérés ou non et répartis sur la région du cou et sur les jambes, concordent ainsi avec ce qui a été rapporté par Lapen et al. (1972).
Conclusion
Les maladies tumorales aviaires ont continué d’être diagnostiquées au Maroc durant les 15 années concernées par l’étude entre 1998 et 2013 (189 cas au total ont été diagnostiqués dans les 3 cabinets vétérinaires) avec au moins un cas par an. La MD constituait la pathologie tumorale la plus fréquente parmi celles recensées avec un pic important entre 2004 et 2006. Elle a sévi chez 90% des cas étudiés alors que les leucoses/sarcomes aviaires ne constituaient que 10% de ces cas et ont été rencontrés essentiellement entre 1998 et 2000. Ces dernières n’ont plus été diagnostiquées depuis l’année 2000, à l’exception d’un seul cas isolé de myxosarcome en 2008. En raison de l’importance de la MD et sa recrudescence en épisodes, il serait intéressant de pousser les investigations afin de déterminer les raisons de leur apparition et éventuellement de procéder à la caractérisation virologique et/ou moléculaire des souches de virus de la MD qui circulent dans le pays en vue de leur comparaison avec les souches vaccinales. Aussi, la sensibilisation des professionnels en aviculture (vétérinaires, éleveurs, couvoirs, techniciens et ouvriers) sur l’importance du respect des procédures de vaccination et des normes de biosécurité au sein des élevages, du transport des poussins, et de leur environnement doit être continue. Enfin l’incitation des vétérinaires avicoles à recourir davantage aux examens de laboratoire notamment histologiques dans le diagnostic différentiel des néoplasmes aviaires serait d’une grande utilité dans les études de l’évolution au Maroc des maladies tumorales aviaires en général et de celle la MD en particulier.
Références
American Association of Avian Pathologists – AAAP. (2013). Avian Disease Manual, 7thEd., Boulianne M. (Ed.), The American Association of Avian Pathologists, 300 pp.
Baigent S.J., Nair V.K., Le Galludecb H. (2016). Real-time PCR for differential quantification of CVI988 vaccine virus and virulent strains of Marek’s disease virus. J. Virol. Methods, 233:23–36.
Biggs P.M., Nair V. (2012). The long view: 40 years of Marek’s disease research and Avian Pathology. Avian Pathol., 41: 3–9.
Boodhoo N., Gurung A., Sharif S. Behboudi S. (2016). Marek’s disease in chickens: a review with focus on immunology. Vet. Res., 47: 119.
Calnek B.W., Harris R.W., Buscaglia C, Schat K.A., Lucio B. (1998). Relationship between the immunosuppressive potential and the pathotype of Marek’s disease virus isolates. Avian Dis. ,42:124–132.
Calnek B.W, Lucio-Martinez B, Cardona C, Harris RW, Schat KA, Buscaglia C. (2000). Comparative susceptibility of Marek’s disease cell lines to chicken infectious anemia virus. Avian Dis., 44:114–124
Calnek B. W. (2001). Pathogenesis of Marek’s disease virus infection. Curr. Top. Microbiol. Immunol., 255: 25-55.
Davison F., Kaiser P. (2004). Immunity to Marek’s disease. In: Marek’s Disease, An Evolving Problem, Davison F. and Nair V. (Eds), London: Elsevier Academic Press. pp. 126–141.
FISA (2014). Développement du secteur avicole au Maroc, Fédération Interprofessionnelle du Secteur Avicole. www.fisa.ma.
Gavora J.S. (1987). Influences of Avian Leukosis Virus Infection on Production and Mortality and the Role of Genetic Selection in the Control of Lymphoid Leukosis. In: De Boer G.F. (Eds) Avian Leukosis. Develop. Vet. Virol., vol. 4. Springer, Boston, MA.
Gimeno I.M. (2008). Marek’s disease vaccines: a solution for today but a worry for tomorrow? Vaccine, 26: C31–C41.
He L., Li J., Zhang Y., Luo J., Cao Y., Xue C. (2018). Phylogenetic and molecular epidemiological studies reveal evidence of recombination among Marek’s disease viruses. Virology, 516: 202–209.
Jayalakshmi K., Selvaraju G. (2016). Epidemiology of Marek’s disease in commercial layer flocks. J. Cell and Tissue Res., 16: 5811-5815.
Kalai Tlamsani H. (1994). Étude rétrospective et comparative entre la souche HVT et Rispens dans la prévention et le contrôle de la maladie de Marek. Thèse pour l’obtention de Doctorat en Médecine Vétérinaire, Institut Agronomique et Vétérinaire Hassan II, Rabat, 90 pp.
Kennedy D.A., Cairns C., Jones M.J., Bell A.S., Salathe R.M., Baigent S.J., Nair V.K., Dunn P.A., Read A.F. (2017). Industry-wide surveillance of Marek’s disease virus on commercial poultry farms. Avian Dis., 61: 153–164.
Kichou F. (1999). Diagnostic pathologique différentiel des leucoses aviaires et la maladie de Marek chez la volaille domestique. L’Espace Vét., 20:11.
Kichou F., Fatihi H., Mouahid M. (2009). Avian myéloïd leukosis: a retrospective study in Morocco. 16ème Congrès Mondial de Pathologie Aviaire de l’Association Mondiale des Vétérinaires Avicoles. Marrakech, 08-12 novembre 2009.
Lapen R.F., Kenzy S.G. (1972). Distribution of gross cutaneous Marek’s disease lesions. Poult. Sci., 51:334–336.
Lawn A.M., Payne L.N. (1979). Chronological study of ultrastructural changes in the peripheral nerves in Marek’s disease. Neuropathol. Appl. Neurobiol., 5: 485–497.
Moquadam C. (1994). Etude anatomo-pathologique de la maladie de Marek chez la poule pondeuse au Maroc. Thèse pour l’obtention de Doctorat en Médecine Vétérinaire. Institut Agronomique et Vétérinaire Hassan II, Rabat, pp 80.
Mouahid M. (1999). Les leucoses myéloïdes aviaires. 16èmeCongrès Vétérinaire Maghrébin. Marrakech, 6-7 Mai.
Morrow C., Fehler F. (2004). Marek’s disease: a worldwide problem. In: Marek’s Disease. An Evolving Problem, F. Davison and V. Nair (Eds), London, Elsevier Academic Press. pp 49–61.
Nair V. (2005). Evolution of Marek’s disease – a paradigm for incessant race between the pathogen and the host. Vet. J., 170:175–183.
Nair V. (2013). Latency and tumorigenesis in Marek’s disease. Avian Dis., 57: 360–365.
Nair V.K. (2018). Spotlight on avian pathology: Marek’s disease, Avian Pathol. 47(5): 440-442,
Payne L.N., Venugopal K. (2000). Neoplastic diseases: Marek’s disease, avian leukosis and reticuloendotheliosis. Rev. sci. tech. Off. int. Epiz. 19: 544-564.
Payne L.N., Nair V. (2012). The long view: 40 years of avian leukosis research. Avian Pathol., 41:1–9.
Robinson C.M., Cheng H.H., Delany M.E. (2014). Temporal kinetics of marek’s disease herpesvirus: integration occurs early after infection in both B and T cells. Cytogenet. Genome Res., 144: 142–154.
Schat K.A., Nair.V (2008). Marek’s Disease. In: Diseases of Poultry 12th Edn., Saif Y.M., Fadly A.M. Glisson J.R., Mcdougald L.R., Nolan L.K. and Swayne D.E. (Eds), Blachwell Publishing, Oxford, pp. 452- 514.
Schat K.A., Nair V. (2013). Marek’s Disease. In: Diseases of Poultry, 13th ed., David E. Swayne (Ed.), John Wiley & Sons, Inc. pp. 516-552.
Sharma J.M. (1983). Effect of Infectious bursal disease virus on protection against Marek’s disease by turkey Herpesvirus vaccine. Avian dis., 28: 629-640.
Wyffels R., El Houadfi M., Bouzooubaa K. (1984). Evolution et situation actuelle des principales maladies aviaires. Actes des 3èmes Journées Avicoles de l’Association Nationale pour la Production Animale. Hommes, Terre et Eaux, pp. 57-58.
Witter R.L. (1997). Increased virulence of Marek’s disease virus field isolates. Avian Dis., 41:149–163.
Witter R.L., Calnek B.W., Buscaglia C., Gimeno I. M, Schat K.A. (2005). Classification of Marek’s disease viruses according to pathotype: philosophy and methodology, Avian Pathol., 34: 75-90.
Publié-e
Comment citer
Numéro
Rubrique
Licence

Revue Marocaine des Sciences Agronomiques et Vétérinaires est mis à disposition selon les termes de la licence Creative Commons Attribution - Pas d’Utilisation Commerciale - Partage dans les Mêmes Conditions 4.0 International.
Fondé(e) sur une œuvre à www.agrimaroc.org.
Les autorisations au-delà du champ de cette licence peuvent être obtenues à www.agrimaroc.org.

