Comprendre le comportement du métapneumovirus aviaire dans les élevages marocains de dinde de chair à travers les investigations sérologiques
Résumé
Le métapneumovirus aviaire (aMPV) est l’agent causal d’une maladie contagieuse et aigue qui touche principalement le tractus respiratoire avec différentes expressions cliniques. Il s’agit de la rhinotrachéite infectieuse chez la dinde, d’infection insidieuse et de syndrome infectieux de la grosse tête en association avec d’autres pathogènes chez le poulet de chair, ou encore de baisses de production avec altération de la qualité de l’œuf et associées à des gênes respiratoires chez les poules pondeuses et les reproductrices. Afin de mieux comprendre le comportement du virus dans les élevages de dinde de chair au Maroc, une enquête sérologique a été menée sur 23 sites présentant des symptômes respiratoires, avec parfois des mortalités. Il s’agit, outre la mise en évidence d’anticorps témoins d’une infection naturelle par aMPV, de déterminer les possibles co-infections chez la dinde, particulièrement en association avec Ornithobacterium rhinotracheale (ORT), à travers une analyse de corrélation des titres d’anticorps dirigés contre les agents des deux maladies. Les résultats obtenus montrent une corrélation forte et positive des anticorps produits contre aMPV et ORT chez la dinde (R = 0,806). Il en découle que le métapneumovirus aviaire peut être très souvent présent en association avec d’autres virus ou bactéries pathogènes respiratoires, tout en étant un agent primaire d’infection.
Mots-clés: métapneumovirus aviaire, aMPV, Rhinotrachéite Infectieuse, RTI, dinde, co-infections, sérologie, corrélation
Téléchargements
INTRODUCTION
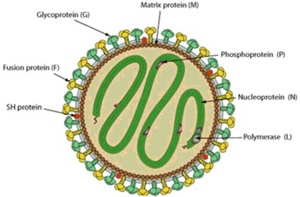
Le métapneumovirus aviaire (aMPV : Avian Metapneumovirus) ou encore anciennement dénommé virus de la rhinotrachéite aviaire (ART: Avian Rhinotracheitis) est tout comme le Paramyxovirus-1, un membre de la famille des Paramyxoviridae. Tous deux sont des virus à ARN monocaténaires et à polarité négative, et se caractérisent par la présence de glycoprotéine F de fusion (Yu et al., 1991). Le métapneumovirus se distingue toutefois par l’absence de l’hémagglutinine H et de la neuraminidase N, faisant que le virus ne présente pas de pouvoir hémagglutinant.
Il possède cependant, et contrairement au virus de la Maladie de Newcastle, une protéine G qui permet de subdiviser le métapneumovirus en quatre sous-types dits A, B, C et D, sur la base des séquences nucléotidiques (Cook et Cavanagh, 2002). Les deux premiers sous-types sont les plus importants en production avicole, avec des études d’évidence de dominance mondiale du sous-type B par rapport au A (Banet-Noach et al. 2005, Jones, 2010). Les protéines F et G ensemble, permettent non seulement la régulation de l’adhésion et la pénétration du virus dans la cellule hôte, éléments-clés de la pathogénie de aMPV, mais interviennent aussi dans la présentation antigénique en indiquant une immunité protective (Juhasz et Easton, 1994, Tanaka et al., 1996).
La métapneumovirose aviaire est une maladie virale aigue et hautement contagieuse du tractus respiratoire supérieur. Selon l’espèce aviaire concernée, la maladie se présentera cliniquement sous différentes formes (Gough, 2003).
• Chez la dinde, la maladie est appelée rhinotrachéite infectieuse. Il s’agit de l’espèce aviaire la plus sensible à aMPV par l’action des mécanismes de la réponse immunitaire innée, notamment la production d’oxyde nitrique ARNm synthase qui s’exprime plus sévèrement que chez l’espèce Gallus (Hartmann et al., 2015). Il est à souligner que malgré les différents isolements de virus apparentés d’origine «poule» ou «dinde», des études ont démontré avec des anticorps monoclonaux et polyclonaux que la structure antigénique des deux virus est similaire, stipulant ainsi une protection croisée (Cook et al., 1993, Collins et al., 1993). Le problème du métapneumovirus chez la dinde réside également dans les coïnfections, où expérimentalement l’introduction de aMPV par aérosol ou par inoculation intra-sac aérien cinq jours avant O. rhinotracheale aggraverait le tableau clinique engendré par la bactérie (Van Empel, 1996). Ces deux infections sont d’ailleurs à apparitions très fréquentes en élevage de dinde entre le début de la phase de production et l’abattage, d’après une étude longitudinale (Van Loock et al., 2005).
• Chez le poulet de chair, l’infection par le métapneumovirus aviaire n’est pas aussi bien définie que chez la dinde, avec même une possibilité d’absence des symptômes cliniques (Cook, 2000). Des chercheurs ont toutefois été capables, en inoculant le virus chez des jeunes sujets, d’induire expérimentalement une maladie respiratoire à symptômes modérés, afin de démontrer la réplication du virus dans le tractus respiratoire par immunofluorescence (Jones et al., 1987). Cette expression de la maladie est d’autant plus évidente lors de l’infection simultanée du poulet avec aMPV et E. coli (El Houadfi et Nassik, communication personnelle, 2014). La maladie est sous-diagnostiquée et se présente tout comme chez la dinde en co-infections avec d’autres agents pathogènes, car les lésions de l’épithélium des cornets augmenteraient la sensibilité des cellules épithéliales aux infections bactériennes secondaires (Majó et al., 1996), ce qui lui donne dans sa forme la plus compliquée cet aspect typique de «grosse tête», ou mieux dit le Syndrome Infectieux de la Grosse Tête (SIGT).
• Chez les poules pondeuses et les reproductrices, en plus de l’atteinte respiratoire, la maladie se manifeste par une baisse de production ainsi qu’une dépréciation de la qualité externe de l’œuf, puisque le virus cible au moins deux sites de réplication, à savoir l’appareil respiratoire et le tractus génital (Hess et al., 2004). La maladie peut être également accompagnée de symptômes nerveux et d’opisthotonos consécutifs à une ostéite crânienne (Hafez, 1993). Même en utilisant un vaccin huileux homologue pour la protection de l’appareil reproducteur, en l’occurrence l’oviducte, le métapneumovirus peut toujours infecter les voies respiratoires et induire des chutes de pontes et à des âges avancés, mais moins sévères, consécutives à la baisse de consommation d’eau et d’aliment (Mouahid, communication personnelle, 2019). Ainsi, pour assurer une protection complète, il est important d’utiliser des vaccins vivants atténués suivis d’une administration d’un inactivé (Cook et al., 2000).
L’étude de cas suivante sera détaillée et discutée dans un but d’une meilleure compréhension de la maladie avec ses aspects précédemment rapportés chez la dinde, dans un contexte de terrain national.
MATÉRIEL ET MÉTHODES
Des prélèvements de sang ont été réalisés dans des élevages de dindes de chair entre 2013 et 2015 (n = 23) répartis sur différentes régions du Royaume: Fès, Gharb, Casablanca-Settat et Beni Mellal, à la suite de manifestation de symptômes respiratoires. Ces prélèvements ont fait l’objet d’analyses sérologiques de type ELISA (Enzyme-Linked Immunosorbent Assay).
Le tableau 1 décrit la distribution géographique de ces fermes, les âges au moment des prélèvements ainsi que les agents pathogènes recherchées dans ce sens.

Tous ces lots ont présenté des symptômes respiratoires à l’issue des prélèvements à des âges différents compris entre 40 et 108 jours, variant entre dyspnées avec jetages clairs et gonflements des sinus infra-orbitaires, orientant les suspicions (consécutivement donc, les prélèvements aussi) essentiellement vers la rhinotrachéite infectieuse, ainsi que parfois des suspicions d’ORT (infection par Ornithobacterium rhinotracheale avec un dépôt de fibrine sur la face costale des poumons, caractéristique (Photo 1).

Les échantillons ont pour finalité la mise en évidence de séroconversions pour les anticorps dirigés contre le métapneumovirus aviaire, les titres élevés et homogènes recherchés témoignant plus d’une infection que de simple vaccination, et ceux dirigés contre O. rhinotrachéale.
Des analyses pour la recherche d’anticorps dirigés contre d’autres agents pathogènes respiratoires, tels le Paramyxovirus-1 ainsi que Mycoplasma gallisepticum, ont été également réalisés dans certains cas, afin d’établir un diagnostic différentiel.
Cette étude tient bien évidemment compte du programme prophylactique instauré au niveau de ces sites, et dont le modèle est rapporté sur le tableau 2.

Les kits utilisés pour la détection des anticorps anti-aMPV et anti-ORT sont, respectivement, IDEXX® APV Ab Test® et IDEXX® Ornithobacterium rhinotracheale (ORT) Ab Test® (IDEXX Laboratories, USA).
Pour ce qui est de la recherche des anticorps anti-NDV et anti-MG, les kits utilisés sont IDEXX® NDV-T Ab test® spécifique pour la dinde, et IDEXX® MG Ab test®.
Il est à noter que les suspicions MG ont été par la suite écartées vu l’apparition des symptômes à des âges précoces et les faibles titres sérologiques obtenus en parallèle, rapportées plus loin (Cf. Résultats et discussion).
Aussi, pour ce qui est de la Maladie de Newcastle, et du fait de sa probabilité réduite lors du diagnostic clinique établi, il est difficile de statuer sur la base de la sérologie uniquement, vu l’administration de vaccin huileux ainsi que le nombre de rappels au cours de l’élevage.
D’un autre côté, les observations cliniques, couplées aux résultats sérologiques élevés obtenus pour ORT, et en contraste avec ceux de aMPV, ont amené à approfondir les investigations par une étude statistique sur les deux atteintes respectives.
Ces données ont donc été traitées avec un logiciel de statistique IBM SPSS® Statistics 23 (IBM®, USA) pour une analyse de corrélation bilatérale entre les titres moyens d’anticorps aMPV (mention sur le logiciel: mean_TRT) et les titres moyens d’anticorps ORT (mention sur le logiciel: mean_TRT) et d’ainsi étudier le degré d’interrelation entre les deux pathogènes, suspectés agir en co-infections.
RÉSULTATS ET DISCUSSION
Le tableau 3 rapporte les résultats sérologiques pour les différents agents pathogènes sur lesquels l’enquête a été réalisée.

L’analyse statistique de la relation bilatérale entre les moyennes des deux sérologies aMPV et ORT, est synthétisée pour les 23 fermes dans le tableau 4.

Les résultats obtenus montrent une corrélation bilatérale forte et positive (R = 0,806) entre les moyennes des titres d’anticorps anti-APV et les moyennes des titres d’anticorps anti-ORT, surtout dans le cas où ces résultats correspondent à une infection naturelle (titres élevés et homogènes, cas de Bir Jdid 1, 2, 3, Berrechid 1, Settat, Saïss…) plutôt qu’à une réponse vaccinale aux différents rappels (souvent très faibles, et hétérogènes, vu que l’immunisation contre le métapneumovirus induite par les vaccins vivants est d’ordre cellulaire essentiellement).
Ainsi, lorsque les titres ORT sont élevés, ceux de aMPV le sont aussi également, et vice-versa. Cette constatation est d’autant plus valable pour une tranche d’âge variant entre 50 et 80 jours (Figure 1).

Les titres très élevés anti-aMPV, témoins d’un contact avec le Métapneumovirus aviaire de terrain, et la sensibilité de l’espèce au virus pourrait expliquer plutôt une relation de causalité entre l’apparition de la rhinotrachéite infectieuse, et ORT par la suite.
Comme le résultat sérologique a été décrit comme corrélé aux observations cliniques dans le cas de ORT (Bazin et al., 2005), les titres élevés obtenus permettent de confirmer l’infection par le germe sur la base des symptômes et lésions constatés auparavant, et qui sont exclusivement d’ordre respiratoire. Ces résultats concordent également avec ce qui a été rapporté concernant la concomitance de la rhinotrachéite infectieuse et ORT (Van Loock et al., 2005), ou encore l’exacerbation de O. rhinotracheale en présence de aMPV (Van Empel et al., 1996).
Il est à souligner que souvent dans les élevages, des traitements métaphylactiques sont administrés afin de contrôler les atteintes respiratoires. Cette pratique permet d’une part d’éviter les infections compliquées, comme les arthrites à Mycoplasma synoviae ou encore les ténosynovites à Ornithobactérium rhinotrachéale (non observées dans notre cas), mais aussi retarder l’expression clinique, ce qui rend difficile l’investigation quant à l’origine de transmission (horizontale ou verticale de ORT).
Il est important de mentionner que dans le cas de la métapneumovirose, et particulièrement la rhinotrachéite infectieuse, les signes cliniques peuvent régresser avant même que les niveaux élevés d’anticorps ne soient décelables (silence immunitaire).
Ceci expliquerait d’une part la présence de symptômes malgré les titres « encore » faibles chez les lots, confirmant notre suspicion quant à l’aspect causal et primaire du métapneumovirus, mais surtout d’autre part l’existence d’un risque important de transmission de l’agent pathogène à partir d’un lot infecté avant l’installation de l’immunité (Panigrahy et al., 2000).
CONCLUSION
A ce jour, peu d’études ont été réalisées concernant le pneumovirus aviaire, et ce pour plusieurs raisons:
• L’apparition récente de la maladie (1978 en Afrique du Sud, 1987 comme première introduction au Maroc) et donc la récence des outils de diagnostic dans ce sens,
• La difficulté de reproduire la maladie dans des conditions expérimentales,
• La complexité de l’immunité induite avec les différences observées entre les espèces aviaires,
• Le pouvoir pathogène du virus, qui en plus d’être agent primaire pour les infections respiratoires, présenterait également un effet immunodépressif en infectant les macrophages (Chary et al., 2002)
La compréhension du virus et des mécanismes de sa pathogénie demeure donc d’une importance cruciale afin de pouvoir mettre en place des stratégies de lutte efficaces, reposant solidement sur la vaccination, notamment chez la dinde.
Il aurait été d’ailleurs judicieux d’évaluer le niveau de protection conféré par les différents types de vaccins commercialisés à l’époque (souches dinde, poule… sous-type A et sous-type B).
RÉFÉRENCES
Alexander D.J. (1991). Avian Pneumovirus. A: Diseases of poultry ed. per B.W. Calnek, H.J. Barnes, C.W. Beard, W.M. Reid and H.W. Yoder. 9th edition, IOWA, Iowa State University Press, 669-673.
Banet-Noach C., Simanov L., Perk S. (2005). Characterization of Israeli avian metapneumovirus strains in turkeys and chickens. Avian Pathol., 34:220-226.
Baxter-Jones C., Jones R.C. (1989). Laboratory investigations with Turkey Rhinotracheitis Virus: virus isolation maintenance and serology. A recent advance in turkey science ed. per C. Nixey and T.C. Grey. London: Poultry Science Symposium series, 21: 225-233.
Bazin T., Balloy D., Mercier A., Paulet P., Belloc C. (2005). Étude de l’infection par Ornithobacterium rhinotracheale en élevages de dindes de chair. 6ème Journées de la Recherche Avicole, St. Malo. 360-364.
Chary P., Rautenschlein S., Njenga M.K., Sharma J.M. (2002). Pathogenic and Immunosuppressive Effects of Avian Pneumovirus in Turkeys. Avian Dis., 46:153 – 61.
Collins M.S., Gough R.E., Alexander D.J. (1993). Antigenic differentiation of Avian Pneumovirus isolates using polyclonal antisera and mouse monoclonal antibodies. Avian Pathology, 22: 469-472.
Cook J.K.A. (2000). Avian pneumovirus infections of turkeys and chikens. The Veterinary Journal, 160: 118-125.
Cook J.K.A., Cavanagh D. (2002). Detection and differentiation of avian pneumoviruses (metapneumoviruses). Avian Pathology, 31:117–132
Cook J.K.A., Chesher J., Orthel F., Woods M.A., Orbell S.J., Baxendale W., Huggins M.B. (2000). Avian pneumovirus infection of laying hens: experimental studies. Avian Pathology, 29: 545 – 556.
Cook J.K.A., Jones B.V., Ellis M.M., Jing L., Cavanagh D. (1993). Antigenic differentiation of Turkey Rhinotracheitis Virus using monoclonal antibodies. Avian Pathology, 22: 257-273.
Gough R.E. (2003). Avian pneumovirus. In: Diseases of poultry 11th edition. SAIF Y.M., IOWA state press. 92-99.
Hafez H.M. (1993). The role of pneumovirus in swollen head syndrome of chickens: review. Arch. Geflügelkde, 57:181-185.
Hartmann, S., Rautenschlein, S., Sid, H. (2015). Avian metapneumovirus infection of chicken and turkey tracheal organ cultures: comparison of virus–host interactions. Avian Pathology, 44: 6.
Hess M., Huggins M.B., Mudzamiri R., Heincz U. (2004). Avian metapneumovirus excretion in vaccinated and non-vaccinated specified pathogen free laying chickens. Avian Pathology, 33: 35-40.
Jones R.C. (2010). Viral respiratory diseases (ILT, aMPV infections, IB): Are they ever under control? Brit. Poult. Sci., 51:1-11.
Jones R.C., Baxter-Jones C., Savage C.E., Kelly D.F., Wilding G.P. (1987). Experimental infection of chickens with a ciliostatic agent isolated from turkeys with rhinotracheitis. Veterinary Record, 120: 301– 302.
Juhasz K., Easton A.J. (1994). Extensive sequence variation in the attachement (G) protein gene of Avian Pneumovirus; evidence for two distinct subgroups. Journal of General Virology, 75: 2873-2880.
Majó N., Marti M., Allan G.M., O’loan C.J., Pages A., Ramis A.J. (1996). Ultrastructural study of turkey rhinotracheitis virus infection in turbinates of experimentally infected chickens. Veterinary Microbiology, 52:37-48.
Majó N., Allan G.M., O’Loan C.J., Pagès A., Ramis A. (1995). A sequencial histopathologic and immunocitochemical study of chickens, turkey poults and broiler breeders experimentally infected with Turkey Rhinotracheitis Virus. Avian Diseases, 39:887-896.
Panigrahy B., Senne D.A., Pederson J.C., Gidelwski T., Edson R.K. (2000). Experimental and serological observations on avian pneumovirus (APV/turkey/Colorado/97) infection in turkeys. Avian Dis., 44: 17-22.
Tanaka M, Obi T., Takuma H., Kokumai N., Higashihara R., Hiramatsu, K., Shimizu, Y. (1996). Inhibition of cell fusion by neutralizing monoclonal antibodies to F1 protein of Turkey Rhinotracheitis Virus. Journal of Veterinary Medical Science, 58: 581-582.
Van Empel P., Van den Bosch D., Goovaerts D., Storm P. (1996). Experimental infection in turkeys and chickens with Ornithobacterium rhinotracheale. Avian Diseases, 40: 858-864.
Van Loock M., Geens T., De Smit L., Nauwynck H., Van Empel P., Naylor C., Hafez H.M., Goddeeris B.M., Vanrompay D. (2005). Key role of Chlamydophila psittaci on Belgian turkey farms in association with other respiratory pathogens. Veterinary Microbiology, 107: 91-101.
Weingarten M. (1994). Pneumovirus infection: turkey rhinotracheitis and swollen head syndrome of chiken. VSD newsletter -Intervet, 8: 1-10.
Yu Q., Davis P.J., Barret T., Binns M.M., Boursnell M.E.G., Cavanagh D. (1991). Deduced aminoacid sequence of the fusion (F) glycoprotein of Turkey Rhinotracheitis Virus has greater identity with that of the human Respiratory Syncitial Virus, a Pneumovirus, than that of paramyxoviru ses and morbilliviruses. Journal of General Virology, 72: 75-81.
Publié-e
Comment citer
Numéro
Rubrique
Licence

Revue Marocaine des Sciences Agronomiques et Vétérinaires est mis à disposition selon les termes de la licence Creative Commons Attribution - Pas d’Utilisation Commerciale - Partage dans les Mêmes Conditions 4.0 International.
Fondé(e) sur une œuvre à www.agrimaroc.org.
Les autorisations au-delà du champ de cette licence peuvent être obtenues à www.agrimaroc.org.

