Application du système de scoring lésionnel pour contribuer à l’étude de la pathogénicité du virus de l’influenza aviaire faiblement pathogène H9N2 chez le poulet de chair infecté expérimentalement
Résumé
Suite à l’introduction du virus de l’influenza aviaire faiblement pathogène H9N2 au Maroc en 2016, une étude de la pathogénicité du virus a été effectuée, pour bien comprendre la pathophysiologie de la maladie et son rôle dans les dégâts observés au niveau du terrain. L’étude a été effectuée dans des conditions contrôlées pour pouvoir ressortir le véritable impact du virus H9N2 seul en limitant les infections concomitantes. Pour ce faire, 110 poulets de chair d’un jour vaccinés à un jour d’âge, contre le virus de l’influenza aviaire faiblement pathogène H9N2, ont été élevés et entretenus dans des isolateurs. A 21 jours, les poussins ont été répartis en trois lots, deux lots (vC, nvC) ont été inoculé par la souche marocaine du virus H9N2 (GenBank accession number : LT 598532) et un lot témoin non challengé (vNC). Les résultats des examens cliniques ont révélé une gêne respiratoire seulement et aucune mortalité. Deux autopsies ont été programmées à 5 et à 12 jours post-challenge. Sur le plan lésionnel, une trachéite, un épaississement des sacs aériens, et une congestion pulmonaire ont été observés pendant la première autopsie, lors de la deuxième, seulement l’épaississement des sacs aériens a persisté. L’étude histopathologique réalisée sur les organes prélevés lors des autopsies, a révélé une trachéite lympho-histiocytaire, une bronchite sévère, une néphrite lymphocytaire légère et une déplétion lymphocytaire au niveau de la rate à 5 jours post challenge, à 12 jours post-challenge, les lésions ont régressé et seulement quelques cas de trachéite ont été détectés. La présente étude est la première à avoir étudié l’effet pathogène du virus seul dans des conditions contrôlées, les résultats indiquent que l’infection par le virus seul ne reproduit pas la maladie telle qu’elle est rapportée dans le terrain et que d’autres facteurs (infections concomitantes, conditions d’élevage et stress environnemental…) peuvent être à l’origine de la gravité des dégâts rapportés, l’équipe a aussi conclu que la souche marocaine du virus de l’IA H9N2 a un tropisme essentiellement respiratoire et un effet néphropathogène faible.
Mots-clés : Influenza aviaire, infection expérimentale, poulet de chair, H9N2, histopathologie
Téléchargements
Introduction
Le virus de l’influenza aviaire faiblement pathogène H9N2 appartient à la famille des orthomyxoviridae du genre Influenzavirus du type A (Alexander, 2000; Capua et Alexander, 2004), c’est un pathotype faiblement pathogène défini par l’index de pathogénicité intraveineuse (IPIV) et par l’analyse de la séquence génétique des acides aminés du site de clivage de l’Hémagglutinine (HA). La pathologie qui en résulte est considérée, parmi les maladies les plus redoutables pour les élevages avicoles. Elle sévit dans tous les pays d’Afrique du Nord, du Moyen orient, d’Asie et quelques pays de l’Europe (Houadfi et al., 2016). Le virus H9N2 est un sous-type faiblement pathogène, par conséquent il n’est pas à déclaration obligatoire à l’OIE. Cependant il est muni d’un pouvoir mutant exceptionnel, qui rend son potentiel pandémique un véritable risque sanitaire (Longping et al., 2014; Wan et al., 2008). La maladie de l’IAFP est très pénalisante sur le plan économique, notamment pour les pays où le secteur avicole est en cours de croissance. Le transport et la vente de la volaille se font à l’état vif et dans des conditions d’hygiène ne respectant pas les normes requises, contribuant ainsi à la dissémination des maladies aviaires, et entravant le contrôle des agents pathogènes. Une épidémie a sévit au Maroc en janvier 2016, au début, elle a occasionné des pertes graves liées à des mortalités ayant atteint 10%, et à une diminution considérable des performances zootechniques (une chute de poids, une chute de ponte allant jusqu’à 80 %) (Houadfi et al., 2016). La présente étude a pour objectif d’étudier la pathogénicité de la maladie de l’influenza aviaire faiblement pathogène H9N2 en étudiant les lésions macroscopiques et microscopiques engendrées par le virus seul, dans des conditions contrôlées, en minimisant les complications par d’autres pathogènes.
Matériel et méthodes
L’expérimentation a concerné 170 poussins souche Ross 308 vaccinés à un jour d’âge par un vaccin bivalent contenant H9N2 et NDV, et issus de parents vaccinés contre H9N2. Le premier jour d’âge, 20 poussins ont été sacrifiés pour l’analyse de la qualité du poussin et les autres ont été placés dans des isolateurs de classe III pour le reste de l’essai.
Vaccin
Un vaccin bivalent inactivé contenant la souche du Moyen-Orient du virus de l’influenza aviaire faiblement pathogène H9N2 et la souche Ulster 2C du virus Newcastle.
Virus
La souche marocaine A/chicken /Morocco/SF1/2016 (Genbank accession number LT598532) isolée au niveau de la DPIV (Division de la Pharmacie et des Intrants Vétérinaires) au début de l’introduction de la maladie au Maroc en janvier 2016, a été utilisée lors de cette étude. Le titre de la souche a été de 107 EID50/ml.
Protocole expérimental
Les poussins ont été élevés dans des isolateurs de classe III en respectant des mesures de biosécurité rigoureuses pour éviter d’introduire des pathogènes avant l’infection expérimentale. Une alimentation ad-libitum a été adoptée avec un aliment commercial de type démarrage puis croissance, la transition étant à 21 jours d’âge. En effet, à 21 jours d’âge, les oiseaux ont été répartis en trois lots contenant chacun 30 oiseaux: lot vC (vacciné et challengé), nvC (non vacciné et challengé), vNC (vacciné et non chalengé/témoin), les lots vC et nvC ont été challengés par voie oculo-nasale par 0.2 ml du virus H9N2. Un suivi quotidien des signes cliniques et des mortalités jusqu’à 15 jours après le challenge a été effectué. Deux autopsies ont été réalisés à 5 Jours Post-Challenge (JPC) et à 12 JPC (15 oiseau/lot/autopsie) lors desquelles, des portions de trachée, poumon, foie, rein, et rate de 5 sujets/ groupe ont été prélevés et conservés dans une solution de formol 10% neutralisé pour l’étude histopathologique.
Tableau 1: protocole expérimentale

Techniques histologiques
Les organes prélevés lors des autopsies ont été la trachée, les poumons, la rate, les reins, et le foie. La solution de fixation utilisée a été le formol phosphaté à 10 %. La déshydratation a été effectuée moyennant des bains d’alcool de concentration croissante (70%, 95%, 100 %). L’inclusion a été faite à la paraffine et les coupes ont été effectuées à 5 microns, ensuite une coloration classique à l’hématoxyline-éosine (H&E) a été réalisée.
Résultats
Résultats de l’examen clinique
Les poulets de chair ont seulement manifesté des gênes respiratoires, qui sont apparus le deuxième jour JPC, avec un pic le 9ème JPC, associées à des râles chez quelques individus des lots challengés. Aucune mortalité n’a été observée au cours de la période d’essai.
Résultats des autopsies
Lésions macroscopiques
A 5 jours post-challenge, seulement une trachéite avec quelques cas de trachéite fibrineuse, la congestion pulmonaire, et l’épaississement des sacs aériens ont été relevés. A 12 jours post-challenge, seulement l’épaississement des sacs aériens a été relevé. Aucune lésion n’a été notée chez les sujets témoins.
Tableau 2: Lésions macroscopiques notées lors des autopsies

Lésions microscopiques
Trachée
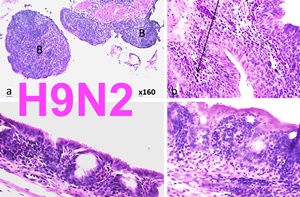
L’étude histopathologique a révélé une trachéite caractérisée par une déciliation, une raréfaction des cellules caliciformes, une infiltration lympho-histiocytaire, et une métaplasie malpighienne des cellules épithéliales. Ces lésions ont été plus sévères à l’autopsie de 5 JPC qu’à celle de 12 JPC (Figure 1).
Figure 1: (a, b, c, d) x400 coupes histologiques de la trachée du poulet de chair infecté expérimentalement par le virus de l’IAFP H9N2 à 21 jours d’âge H&E. a: trachée normal du poulet de chair à 12 JPC (retour à la normale). b: trachéite grade 1 caractérisée par une déciliation diffuse et une infiltration modérée par les lymphocytes. c,d: trachéite grade 3 caractérisée par une infiltration lymphocytaire diffuse, disparition des cellules caliciformes et de cellules ciliées, et une hyperplasie épithéliale sévère.

Tableau 3: résultats du scoring lésionnel des lésions trachéales des sujets challengés

Poumons
Les prélèvements du poumon à 5 JPC ont présenté une bronchite sévère chez tous les sujets challengés, la lésion est caractérisée par une infiltration lympho-histiocytaire diffuse, associées à une réaction du système lymphoïde associé aux bronches (BALT) [figure 2 (a, b, c, d, e, et f)] H&E x160. Au niveau du parenchyme, une hémorragie sévère a été relevée, qui est probablement due à la méthode d’euthanasie utilisée (dislocation cervicale) (figure 2, e), et une prolifération des cellules épithéliale a été notée chez tous les sujets challengés. (figure 2, f).
Figure 2: lésions histopathologiques relevées au niveau des poumons du poulet de chair 5 jours après l’infection expérimentale par le virus H9N2. (H&E).

a: bronchite associée à une infiltration lymphocytaire diffuse et un BALT réactionnel (B), b bronchite modérée avec des lymphocytes (L) dispersés au niveau de la lamina propria, la couche épithéliale est normale c: bronchite légère avec infiltration lymphocytaire, d: un agrégat lymphoide (BALT) réactionnel (B) au niveau de la lamina propria d’une bronche associé à l’œdème (O) du prenchyme, e: un BALT réactionnel au niveau du parenchyme pulmonaire, associé à une hémorragie intraluminale et intraépithéliale, f: hémorragie sévère avec infiltration lymphocytaire et prolifération des cellules épithéliales des capillaires aériens (flèches).
Rate
Au niveau de la rate, une déplétion lymphocytaire sévère a été relevée chez 3 sujets du lot nvC et 3 sujet du lot vC à 5 JPC. La lésion a été associée à une hémorragie Figure 3 (a, b, c, d) x400, H&E.
Figure 3: lésions histopathologiques au niveau de la rate chez un poulet de chair 5 jours après l’infection expérimentale par le virus de l’influenza aviaire H9N2 H&E. a: déplétion lymphoïde sévère associée à une légère hémorragie (H). b: les lésions décrites au niveau de l’image à un grossissement plus élevé, noter l’hémorragie à la périphérie de la zone de déplétion lymphocytaire (DL)). c: artère centrale entourée par un œdème et une nécrose fibrinoide de la paroi artérielle (O), le reste du parenchyme se caractérise par une déplétion lymphoïde modérée et de l’hémorragie. d: coupe normale de la rate chez un sujet témoin. Deux artères centrales (flèches) entourées par des cellules réticulées = gaine ellipsoïde, un PELS: gaine lymphoide périellipsoide formée principalement par des lymphocytes B (BL) et une gaine lymphoide périatérielle contenant principalement des lymphocytes T (TL), (H) en bas à gauche de la section représente des hématies.

Reins
Les reins ont présenté une réaction inflammatoire caractérisée par une infiltration lymphocytaire et une hyperhémie des vaisseaux chez 2 sujets du lot nvC et 1 sujet du lot nvC à 5 JPC, des lésions évoquant l’autolyse post-mortem ont aussi été notées chez tous les sujets à savoir une dégénérescence de l’épithélium des tubules rénaux avec caryolyse et vacuolisation du cytoplasme des cellules épithéliales (figure 4, c). Les figures 4 a, b et d montrent des agrégats lymphoïdes avec des vaisseaux congestionnés (figure 4, b).
Figure 4: lésions au niveau des reins du poulet de chair infectés expérimentalement par le virus de l’influenza aviaire faiblement pathogène H9N2 (H&E). a: agrégat lymphoïde (AL) dans une zone corticale des reins avec des vaisseaux hyperhémiés. b: infiltration lymphocytaire et dégénérescence des tubules contournés proximaux à droite de la section, notez la différence avec les parties gauches, un agrégat lymphoïde (AL) se trouve au centre. c: fort grossissement montrant un glomérule (G) et des tubules contournés proximaux (TCP) dégénérés, avec caryolyse des cellules épithéliales. d: fort grossissement d’un agrégat lymphoïde associé à une hypérémie d’un vaisseau (H).

Foie
Des lésions hépatiques non spécifiques ont été relevées chez quelques sujets, indépendamment de la date et du lot, à savoir des cas de péricholangite associée à une infiltration lymphocytaire et une hypérémie des vaisseaux avec réaction de cellules de Kupffer (figure 5 a, b, c, d).
Figure 5: lésions histopathologiques, au niveau hépatique, notées chez un poulet de chair 5 jours après l’infection expérimentale par le virus de l’influenza aviaire faiblement pathogène H9N2. a: péricholangite (C) entourée par un infiltrat de lymphocytes (L), et une hypérémie de la veine porte. b: congestion sévère avec dégénérescence des hépatocytes autour d’un espace porte. c: espace porte montrant une congestion sévère, et un agrégat de lymphocytes d: dégénérescence hépatocellulaire des cellules entourant une veine centrale (V). H pour globules rouges.

Discussion
L’aspect histopathologique de l’IAFP à H9N2 est largement étudié par des infections expérimentales chez des poulets, le plus souvent poulet SPF et poulet de chair. Le virus est inoculé seul, ou le plus souvent en association avec un autre agent pathogène. En outre, différentes voies d’inoculation ont été testées. Les lésions macroscopiques et microscopiques sont étudiées et rapportées, contrairement des cas du terrain qui rapportent le plus souvent que l’aspect macroscopique. Les lésions macroscopiques notées lors de cette étude sont une trachéite congestive avec quelques cas de trachéites fibrineuses, l’épaississement des sacs aériens, et une congestion pulmonaires. Les oiseaux de cette étude ont présenté des lésions moins sévères que les cas de terrain qui ont présenté des trachéites congestives et hémorragiques, avec des bouchons fibrineux au niveau de la bifurcation trachéale, des pneumonies fibrineuses, des aérosacculites, et occasionnellement des hypertrophies des reins, du foie et de la rate (Houadfi et al., 2016). Ceci peut être expliqué par les infections concomitantes au niveau des cas de terrain. En effet les poulets objets de cette étude ont été élevés dans des isolateurs avec le respect des mesures de biosécurité rigoureuses, ce qui a minimisé le risque de coïnfections, par conséquent les signes cliniques et les lésions relevées sont dues, seulement, au pouvoir pathogène du virus H9N2. En effet Gharaibeh (2008) a réalisé une étude de la pathogénicité du virus H9N2 chez des poulets de chair et des poulets SPF, il a rapporté des râles trachéaux modérés et une perte de poids. Sur le plan lésionnel, il a décrit une congestion et une inflammation lympho-plasmocytaire de la trachée, des sacs aériens et des poumons. Ils ont aussi précisé que les symptômes et les lésions rapportées sont plus prononcés chez le poulet de chair comparativement au poulet SPF. Par ailleurs, (Stipkovits et al., 2012b) ont rapporté des symptômes et des lésions plus sévères chez les poulets infectés par le virus de l’IAFP H3N8 et mycoplasma gallissepticum, comparativement à ceux infecté par les deux pathogènes séparément, des résultats identiques ont été rapportés par Subtain et al, 2016 suite à une étude de co-infection par H9N2 et M. Gallisepticum. Kishida et al, 2004 ont également signalé que la co-infection du virus H9N2 avec staphylococcus aureus ou Haemophilus paragallinarum non seulement exacerbe le tableau clinique et lésionnel du virus mais aussi promeut la réplication du virus et facilite son isolement sur les organes des poulets co-infectés. Nili et Asasi (2002) et Nili et Asasi (2003) ont affirmé que les infections concomitantes ont occasionné des mortalités allant de 20 à 60% au niveau du terrain, et sont aussi responsables de la gravité variable de la maladie. L’effet de la co-infection avec le virus de la bronchite infectieuse a aussi été démontré par les études de (Hassan et al., 2010, 2017). De plus, l’effet synergique du virus H9N2 avec des vaccins contre d’autres pathogènes a été également démontré. (Haghighat-Jahromi et al., 2008) ont affirmé que la co-infection du virus H9N2 avec le vaccin vivant de la bronchite infectieuse augmente la sévérité des signes cliniques et du taux de mortalité chez le poulet. (Ellakany et al., 2018) ont affirmé qu’une vaccination par le vaccin vivant contre le virus Newcastle contenant la souche LaSota chez un lot de poulet de chair infecté par le virus de l’IAFP H9N2 potentialise le pouvoir pathogène du virus H9N2. Le mécanisme de l’effet synergique entre le virus H9N2 et les autres pathogènes étudiés n’est pas encore élucidé, certaines études hypothétisent que l’infection à H9N2 prédispose les oiseaux aux surinfections. Effectivement (Barbour et al., 2009) ont affirmé que l’infection par le virus H9N2 prédispose le poulet à d’autres infections par des pathogènes, tels que Escherichia coli, causant des symptômes respiratoires légers chez le poulet de chair, et aucun symptôme chez le poulet SPF. En effet (Xing et al., 2008) ont prouvé l’effet immunomodulateur du virus H9N2, celui-ci induit une apoptose des macrophages, a un effet inhibiteur sur plusieurs cytokines, notamment l’interleukine-4 qui est important pour la différenciation et la réponse des Th2, par conséquent il diminue l’activation des lymphocytes B spécifiques. H9N2 freine également la production d’interféron. Tous ces effets immunomodulateurs expliquent la sévérité de l’infection par le virus H9N2, en particulier en cas de synergie avec d’autres agents pathogènes. En effet (Stipkovits et al., 2012a) ont argumenté que l’immunosuppression due à l’infection à M. gallisepticum prédispose les oiseaux aux infections y compris l’infection au virus de l’influenza, (Kwon et al., 2008) ont aussi remarqué l’augmentation de la charge virale en H9N2 chez les oiseaux immunodéprimés, de même (El Miniawy et al., 2014) ont étudié l’effet de l’immunosuppression due aux mycotoxines sur la pathogénicité du virus H9N2.
Lors de cette étude, l’équipe a remarqué que les symptômes et les lésions siègent, principalement au niveau de l’appareil respiratoire, et à moindre degré au niveau des reins (légère néphrite interstitielle lymphocytaire), et aucun symptôme ou lésion du tube digestif n’a été soulevé, (Aslam et al., 2015) n’ont pas relevé aucune lésion macroscopique chez des oiseaux euthanasiés après une infections expérimentale par voie oculo-nasale, et orale, par contre un tableau lésionnel identique à celui de cette étude a été rapporté chez les oiseaux qui ont succombé naturellement. (HABL et al., 2003) ont relevé des lésions siégeant dans les reins et le pancréas suite à une inoculation intraveineuse du virus. Les mêmes auteurs ont rapporté une trachéite associée à une pneumonie et une néphrite tubulo-interstitielle après une inoculation intra-trachéale (HABL et al., 2004). Les lésions histopathologiques relevées lors de cet essai, siègent majoritairement au niveau l’appareil respiratoire. Ces résultats sont similaires à ceux de (Nili and Asasi, 2002) et (Capua et al., 2000), qui ont rapporté une prédominance des lésions respiratoires et plus précisément une trachéite nécrotique. Par ailleurs, (Aslam et al., 2015) (Capua and Alexander, 2009), ont rapporté une fréquence élevée des lésions au niveau de l’appareil respiratoire et gastro-intestinal. Ces résultats diffèrent de ceux rapportés par (Shalaby et al., 1994; Slemons et al., 1990; Swayne and Pantin-Jackwood, 2006; Swayne et al., 1994; Swayne and Slemons, 1992, 1995; Swayne and Slemons, 1990) qui ont démontré que l’inoculation du poulet par voie intra-nasale et intra-trachéale par le virus de l’IAFP, occasionne des mortalités et des lésions rénales chez des poussins d’un jour et des poules adultes, de même (HABL et al., 2004) ont inoculé des poulets de cinq semaines d’âge par le virus IAFP H9N2, par voie intratrachéale, ils ont remarqué que la néphrite tubulo-interstitielle et la pancréatite ont été les lésions les plus fréquentes, ainsi (Mosleh et al., 2009) ont affirmé que le virus H9N2 est néphropathique, et (Hadipour et al., 2011) ont rapporté une néphrite tubulo-interstitielle lymphocytaire observée à partir du 6ème jour post-infection chez 26,6% des poulets infectés par le virus H9N2. (Subtain et al., 2011) ont aussi rapporté une tuméfaction des glomérules rénaux associée à une infiltration leucocytaire dans la région tubulaire des reins chez 55% des sujets infecté par voie intraveineuse par le virus de l’IAFP H9N2 des résultats concordant avec ceux de (Slemons et al., 1991) qui ont démontré que le rein est l’organe cible du virus H9N2 lorsque l’inoculation se fait par voie intraveineuse. Certes l’excrétion cloacale du virus de l’influenza aviaire peut être causée par une atteinte intestinale, de la bourse de Fabricius, ou encore par l’atteinte rénale. Ces variations de tropisme peuvent être expliquées par la voie d’inoculation utilisée (le virus se retrouve dans le rein lorsque la voie veineuse est utilisée), la «dose » virale, la différence entre les souches virales utilisées, les conditions de l’expérimentation, la souche et l’état des oiseaux utilisés lors de l’expérimentation (Subtain et al., 2011). Les lésions pulmonaires notées au cours de cette étude chez le poulet de chair sont une bronchite associée à une prolifération des cellules épithéliale, au niveau de la rate une déplétion lymphoïde, et au niveau du foie et du rein des agrégats lymphoides qui sont des structures normales chez les oiseaux (Abdul-Aziz et al., 2016; Fletcher, 2008). En effet, les poulets témoins ont aussi présenté des formations lymphoïdes au niveau du poumon, foie, et du rein lors de cette étude. La dégénérescence des cellules épithéliales des tubules rénaux et des hépatocytes, est probablement un artéfact dû à l’autolyse post-mortem et la longue durée de fixation des spécimens et il ne faut pas les confondre avec une véritable lésion due au virus, en effet (Abdul-Aziz et al., 2016; Fletcher, 2008) expliquent dans leurs atlas de l’histopathologie aviaire (avian histopathology 3ème et 4ème édition) au niveau de la partie dédiée à l’appareil urinaire, que les artéfacts dus à l’autolyse comprennent une vacuolisation des cellules épithéliales avec détachement de l’épithélium de la membrane basale, pycnose et caryolyse des noyaux ce qui concorde avec les trouvailles de cette étude.
Conclusion
En conclusion la souche marocaine du virus H9N2 a un effet pathogène principalement sur l’appareil respiratoire et à moindre degré néphropathogène. Elle engendre une trachéite lymphocytaire sévère après les premiers jours de l’infection caractérisée par une suppression des cellules spécialisées (cellules ciliées et cellules caliciformes) cruciales pour la clairance respiratoire éliminant ainsi la première barrière physique contre les agents pathogènes présents dans l’environnement des oiseaux. Le virus a aussi généré une réaction inflammatoire au niveau des reins. L’étude a été réalisée dans des isolateurs, ce qui explique l’absence de mortalités et de symptômes et de lésions typiquement décrits au niveau des cas de terrain. Cela témoigne, en grande partie, que le moyen de contrôle le plus pertinent contre le virus H9N2 est le respect des mesures de biosécurité.
Références
Abdul-Aziz, T., Fletcher, O.J., Barnes, H.J., Shivaprasad, H., Swayne, D.E., 2016. Avian histopathology. American Association of Avian Pathologists.
Aslam, R., Aslam, A., Tipu, Y., Nazir, J., Ghafoor, A., Fatima, S., 2015. Histopathological and immunohistochemical studies for the pathogenesis of a low pathogenicity H9 avian influenza virus in experimentally infected commercial broilers. J An Plant Sci 25, 45-52.
Barbour, E.K., Mastori, F.A., Nour, A.A., Shaib, H.A., Jaber, L.S., Yaghi, R.H., Sabra, A., Sleiman, F.T., Sawaya, R.K., Niedzwieck, A., 2009. Standardisation of a new model of H9N2/Escherichia coli challenge in broilers in the Lebanon. Vet. Ital 45, 317-322.
Capua, I., Alexander, D., 2009. Avian influenza infection in birds: a challenge and opportunity for the poultry veterinarian. Poultry science 88, 842-846.
Capua, I., Alexander, D.J., 2004. Avian influenza: recent developments. Avian Pathology 33, 393-404.
Capua, I., Mutinelli, F., Marangon, S., Alexander, D.J., 2000. H7N1 avian influenza in Italy (1999 to 2000) in intensively reared chickens and turkeys. Avian Pathology 29, 537-543.
El Miniawy, H.M., Ahmed, K.A., El-Sanousi, A.A., Khattab, M.M.S., 2014. Effect of aflatoxin induced immunosuppression on pathogenesis of H9N2 avian influenza virus. Pak Vet J 34, 234-238.
Ellakany, H.F., Gado, A.R., Elbestawy, A.R., Abd El-Hamid, H.S., Hafez, H.M., Abd El-Hack, M.E., Swelum, A.A., Al-Owaimer, A., Saadeldin, I.M., 2018. Interaction between avian influenza subtype H9N2 and Newcastle disease virus vaccine strain (LaSota) in chickens. BMC veterinary research 14, 358.
Fletcher, O.J., 2008. Avian histopathology.
Gharaibeh, S., 2008. Pathogenicity of an avian influenza virus serotype H9N2 in chickens. Avian diseases 52, 106-110.
HABL, A.M., SOHRABI, H.D.I., Pourbakhsh, S., Gholami, M., 2003. A study on histopathologic changes in chicken following intravenous inoculation with avian influenza virus A/Chicken/Iran/259/1998 (H9N2).
HABL, A.M., SOHRABI, H.D.I., Pourbakhsh, S., Gholami, M., 2004. Histopathological study of intratracheally inoculated A/Chicken/Iran/259/1998 (H9N2) influenza virus in chicken.
Hadipour, M., Farjadian, S., Azad, F., Kamravan, M., Dehghan, A., 2011. Nephropathogenicity of H9N2 avian influenza virus in commercial broiler chickens following intratracheal inoculation. J. Anim. Vet. Adv. 10, 1706-1710.
Haghighat-Jahromi, M., Asasi, K., Nili, H., Dadras, H., Shooshtari, A., 2008. Coinfection of avian influenza virus (H9N2 subtype) with infectious bronchitis live vaccine. Archives of virology 153, 651-655.
Hassan, K.E., Ali, A., Shany, S.A., El-Kady, M.F., 2010. Experimental co-infection of infectious bronchitis and low pathogenic avian influenza. Virology journal 3, 78.
Hassan, K.E., Ali, A., Shany, S.A., El-Kady, M.F., 2017. Experimental co-infection of infectious bronchitis and low pathogenic avian influenza H9N2 viruses in commercial broiler chickens. Research in veterinary science 115, 356-362.
Houadfi, M.E., Fellahi, S., Nassik, S., Guérin, J.-L., Ducatez, M.F., 2016. First outbreaks and phylogenetic analyses of avian influenza H9N2 viruses isolated from poultry flocks in Morocco. Virology journal 13, 140.
Kishida, N., Sakoda, Y., Eto, M., Sunaga, Y., Kida, H., 2004. Co-infection of Staphylococcus aureus or Haemophilus paragallinarum exacerbates H9N2 influenza A virus infection in chickens. Archives of virology 149, 2095-2104.
Kwon, J.-S., Lee, H.-J., Lee, D.-H., Lee, Y.-J., Mo, I.-P., Nahm, S.-S., Kim, M.-J., Lee, J.-B., Park, S.-Y., Choi, I.-S., 2008. Immune responses and pathogenesis in immunocompromised chickens in response to infection with the H9N2 low pathogenic avian influenza virus. Virus research 133, 187-194.
Longping, V.T., Hamilton, A.M., Friling, T., Whittaker, G.R., 2014. A novel activation mechanism of avian influenza virus H9N2 by furin. Journal of virology 88, 1673-1683.
Mosleh, N., Dadras, H., Mohammadi, A., 2009. Evaluation of H9N2 avian influenza virus dissemination in various organs of experimentally infected broiler chickens using RT-PCR. Iranian Journal of Veterinary Research 10, 12-20.
Nili, H., Asasi, K., 2002. Natural cases and an experimental study of H9N2 avian influenza in commercial broiler chickens of Iran. Avian Pathology 31, 247-252.
Nili, H., Asasi, K., 2003. Avian influenza (H9N2) outbreak in Iran. Avian diseases 47, 828-831.
Shalaby, A.A., Slemons, R.D., Swayne, D.E., 1994. Pathological studies of A/chicken/Alabama/7395/75 (H4N8) influenza virus in specific-pathogen-free laying hens. Avian diseases, 22-32.
Slemons, R., Condobery, P., Swayne, D., 1991. Assessing pathogenicity potential of waterfowl-origin type A influenza viruses in chickens. Avian diseases, 210-215.
Slemons, R., Locke, L., Sheerar, M.G., Duncan, R., Hinshaw, V.S., Easterday, B., 1990. Kidney lesions associated with mortality in chickens inoculated with waterfowl influenza viruses. Avian diseases, 120-128.
Stipkovits, L., Egyed, L., Palfi, V., Beres, A., Pitlik, E., Somogyi, M., Szathmary, S., Denes, B., 2012a. Effect of low-pathogenicity influenza virus H3N8 infection on Mycoplasma gallisepticum infection of chickens. Avian Pathology 41, 51-57.
Stipkovits, L., Glavits, R., Palfi, V., Beres, A., Egyed, L., Denes, B., Somogyi, M., Szathmary, S., 2012b. Pathologic lesions caused by coinfection of Mycoplasma gallisepticum and H3N8 low pathogenic avian influenza virus in chickens. Veterinary pathology 49, 273-283.
Subtain, S., Chaudhry, Z.I., Anjum, A.A., Maqbool, A., Sadique, U., 2011. Study on pathogenesis of low pathogenic avian influenza virus H9 in broiler chickens. Pakistan Journal of Zoology 43.
Subtain, S., Manzoor, S., Khan, F., Hussain, Z., Mukhtar, M., 2016. Study on coinfection of Mycoplasma gallisepticum and low pathogenic avian influenza virus H9 in broilers. J. Antivir. Antiretrovir 8, 95-99
Swayne, D., Pantin-Jackwood, M., 2006. Pathogenicity of avian influenza viruses in poultry. Developments in biologicals 124, 61-67.
Swayne, D., Radin, M., Hoepf, T., Slemons, R., 1994. Acute renal failure as the cause of death in chickens following intravenous inoculation with avian influenza virus A/chicken/Alabama/7395/75 (H4N8). Avian diseases, 151-157.
Swayne, D., Slemons, R., 1992. Evaluation of the kidney as a potential site of avian influenza virus persistence in chickens. Avian Diseases, 937-944.
Swayne, D., Slemons, R., 1995. Comparative pathology of intravenously inoculated wild duck-and turkey-origin type A influenza viruses in chickens. Avian diseases, 74-84.
Swayne, D.E., Slemons, R.D., 1990. Renal pathology in specific-pathogen-free chickens inoculated with a waterfowl-origin type A influenza virus. Avian diseases, 285-294.
Wan, H., Sorrell, E.M., Song, H., Hossain, M.J., Ramirez-Nieto, G., Monne, I., Stevens, J., Cattoli, G., Capua, I., Chen, L.-M., 2008. Replication and transmission of H9N2 influenza viruses in ferrets: evaluation of pandemic potential. PloS one 3, e2923.
Xing, Z., Cardona, C.J., Li, J., Dao, N., Tran, T., Andrada, J., 2008. Modulation of the immune responses in chickens by low-pathogenicity avian influenza virus H9N2. Journal of General Virology 89, 1288-1299.
Publié-e
Comment citer
Numéro
Rubrique
Licence

Revue Marocaine des Sciences Agronomiques et Vétérinaires est mis à disposition selon les termes de la licence Creative Commons Attribution - Pas d’Utilisation Commerciale - Partage dans les Mêmes Conditions 4.0 International.
Fondé(e) sur une œuvre à www.agrimaroc.org.
Les autorisations au-delà du champ de cette licence peuvent être obtenues à www.agrimaroc.org.

